题目内容
【题目】按要求回答下列问题:
(1)在25℃、101kPa下,1gCH3OH(l)燃烧生成CO2(g)和H2O(l)时放热22.68kJ。则CH3OH燃烧的热化学方程式为_________________________。
(2)若以(1)中反应原理设计成甲醇燃料电池,电解质溶液为20%~30%的 KOH溶液,则该燃料电池的负极电极反应式为_________________________。
(3)将pH=3的CH3COOH溶液稀释100倍后,溶液的pH范围是____________;将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,溶液显____性(填“酸”、“碱”或“中”)
(4)某温度下,反应2NH3(g)![]() N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。若某时刻向该容器内通入一定量氨气,则化学平衡________移动(填“正向”、“逆向”或“不”)。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动(填“正向”、“逆向”或“不”)。
N2(g)+3H2(g)于恒容密闭容器中达到平衡状态。若某时刻向该容器内通入一定量氨气,则化学平衡________移动(填“正向”、“逆向”或“不”)。若某时刻容器内所有物质的浓度均增加为原来的2倍,则化学平衡________移动(填“正向”、“逆向”或“不”)。
【答案】 2CH3OH (l)+3O2(g)=2CO2(g)+ 4H2O(1) ΔH=-1451.52kJ/mol CH3OH-6e-+8OH-= CO32-+6H2O 3 酸 正向 逆向
【解析】(1)CH3OH(l)燃烧的化学方程式为:2CH3OH+3O2=2CO2+4H2O,在25℃、101kPa下,1gCH3OH(l)燃烧生成CO2(g)和H2O(l)时放热22.68kJ,所以该条件下2molCH3OH(质量为64g)燃烧生成CO2(g)和H2O(l)时放热22.68kJ×64=1451.52kJ,故CH3OH燃烧的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1451.52kJ/mol。
(2)甲醇燃料电池,甲醇在负极失电子发生氧化反应,碱性电解质溶液中,OH-会参与负极反应,生成CO32-和H2O,负极电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O。
(3)pH=3的CH3COOH溶液氢离子浓度为10-3mol/L,醋酸是弱电解质,在水溶液中存在电离平衡,加水稀释促进醋酸电离,所以将pH=3的CH3COOH溶液稀释100倍后,氢离子浓度大于10-5mol/L,小于10-3mol/L,所以溶液的pH范围是:3<pH<5;常温下pH=3的CH3COOH溶液的物质的量浓度远大于10-3mol/L,pH=11的NaOH溶液的物质的量浓度等于10-3mol/L,二者等体积混合反应后,CH3COOH剩余很多,则溶液显酸性。
(4)恒温恒容条件下,通入氨气,增大了反应物的浓度,化学平衡正向移动;若某时刻容器内所有物质的浓度均增加为原来的2倍,浓度商Q1=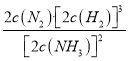 =
=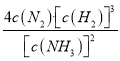 ,因为原平衡浓度商Q=
,因为原平衡浓度商Q=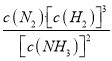 =K,所以改变的条件使浓度商Q1>K,则化学平衡逆向移动。
=K,所以改变的条件使浓度商Q1>K,则化学平衡逆向移动。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案