题目内容
下列物质中,中心原子的杂化类型为sp3杂化的是
| A.C2H6 | B.C2H2 | C.BF3 | D.C2H4 |
A
解析试题分析:A、乙烷分子中C原子周围是4个共价单键,所以C原子是sp3杂化,正确;B、乙炔分子中的C原子的周围是一个碳碳三键和1个共价单键,所以σ键的个数是2,所以是sp杂化,错误;C、BF3分子中的B的最外层电子都参与成共价单键,所以是sp2杂化,错误;D、乙烯分子中的C原子周围有2个共价单键和1个碳碳双键,σ键的个数是3个,所以是sp2杂化,错误,答案选A。
考点:考查分子中原子的杂化方式的判断

练习册系列答案
相关题目
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(2)TY2中心原子的杂化方式为_______;XY2中一个分子周围有__________个紧邻分子;堆积方式与XY2晶胞类型相同的金属有_________(从“Cu、 Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)Z的第一电离能比Mg的________(填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 。
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是 ,原因是 。
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T。已知:
① XO(g)+ 1/2O2(g)=XO2(g) ΔH="-283.0" kJ·mol-1 ② T(s)+O2(g)=TO2(g) ΔH="-296.0" kJ·mol-1
此反应的热化学方程式是______________________________。
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方PT晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算)。
已知BeCl2为共价化合物。 下列对于BeCl2分子的说法正确的是
| A.由极性键构成的极性分子 | B.由非极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由极性键构成的非极性分子 |
以下大小关系不正确的是
| A.熔点:Na>Mg | B.硬度:金刚石>晶体硅 |
| C.键能:H—F>H—Cl | D.晶格能:NaF>NaCl |
下列过程中,共价键被破坏的是 ( )
| A.碘升华 | B.HCl气体溶于水 | C.酒精溶于水 | D.溴蒸气被木炭吸附 |
下列电子式书写正确的是
A.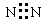 | B. | C.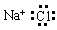 | D.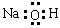 |
下列关于丙烯(CH3—CH=CH2)的说法正确的是
| A.一个丙烯分子中有8个σ键和1个π键 |
| B.丙烯分子中3个碳原子可能在同一直线上 |
| C.丙烯分子中3个碳原子都是sp3杂化 |
| D.丙烯分子中不存在非极性键 |
某元素的原子最外层只有一个电子,它跟卤族元素结合时形成的化学键
| A.一定是共价键 | B.一定是离子键 |
| C.可能是共价键,也可能是离子键 | D.上述说法都不正确 |