题目内容
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(2)TY2中心原子的杂化方式为_______;XY2中一个分子周围有__________个紧邻分子;堆积方式与XY2晶胞类型相同的金属有_________(从“Cu、 Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)Z的第一电离能比Mg的________(填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 。
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是 ,原因是 。
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T。已知:
① XO(g)+ 1/2O2(g)=XO2(g) ΔH="-283.0" kJ·mol-1 ② T(s)+O2(g)=TO2(g) ΔH="-296.0" kJ·mol-1
此反应的热化学方程式是______________________________。
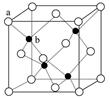
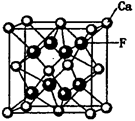
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方PT晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算)。
(1)三 ⅣA 大 (2) sp2 12 Cu 74% (3)小 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(4)SiO2+2OH—= SiO32-+H2O SiO2 SiO2 为原子晶体,CO2为分子晶体
(5)2CO(g)+SO2(g)═S(s)+2CO2(g)△H=-270kJ/mol (6)ds 4.1
解析试题分析:根据题意可知X是C;Y是O;Z是Al;W是Si;T是S;P是Zn。(1)Si位于元素周期表第三周期第ⅣA。Si、C是同一主族的元素,由于从上到下原子核外电子层数增多,所以原子半径增大,因此Si的原子半径比C大;(2)(2)在SO2中的中心原子S的杂化方式为sp2杂化。CO2是分子晶体。在CO2中一个分子周围有12个CO2分子与其紧密相邻。堆积方式与CO2晶胞类型相同的金属有Cu。其空间利用率为74%。(3)Al的核外电子排布为1s22s22p63s1,当它失去第一个电子后变为全空的稳定状态。所以其第一电离能比Mg的小。Al单质与NaOH溶液反应的化学方程式为2Al+2NaOH+ 2H2O= 2NaAlO2+3H2↑。(4)SiO2是酸性氧化物,能与碱反应得到盐和水。其与NaOH溶液反应的离子方程式是SiO2+2OH—= SiO32-+H2O。SiO2 为原子晶体,原子间以共价键结合,共价键是一种强烈的相互作用,断裂需要消耗很多的能量;而CO2为分子晶体,分子间以分子间作用力结合。分子间作用力比化学键弱的多,所以二者比较熔沸点较高的是SiO2。①×2-②。整理可得2CO(g)+SO2(g)═S(s+2CO2(g)△H=-270kJ/mol。(6)30号元素Zn在周期表中位于第四周期第ⅡB族,属于ds区的元素。由ZnS的晶体结构示意图可知:在该晶体的一个晶胞中含有Zn:1/8×8+1/2×6=4;含有S:1×4=4.既一个晶胞中含有4个ZnS。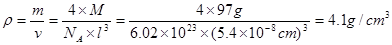 。
。
考点:考查元素的推断、元素周期表、元素周期律的应用、热化学方程式的书写及晶体结构的知识。

(15分)W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数的变化如右图所示,已知W的一种同位素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻,N的单质是日常生活中常用的金属材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最强。
(1)W的另一种同位素的质子数与中子数相等,原子符号表示为 ;元素Y在周期表中的位置是 。
(2)下列有关物质性质的比较中,正确的是 (填字母编号)。
| A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X |
| B.M、X、Z三种元素形成的单质熔点:X>M>Z |
| C.Y、Z两种元素的含氧酸酸性:Z>Y |
| D.Y、Z两种元素的单核阴离子还原性:Y>Z |
(4)元素X与Z形成的五原子分子的空间结构属于 形。
(5)与Z同族的元素都能与氢元素形成氢化物,其中水溶液酸性最弱的是 (填化学式)。
(6)含有N元素的两种离子在溶液中相遇能快速发生反应,写出该反应的离子方程式 。
某学生在做元素性质与原子结构关系的实验时,设计了一套实验方案,并记录了有关的实验现象。请帮助该学生整理并完成实验报告。
(1)实验目的
探究同一主族元素性质的递变规律。
(2)实验用品
仪器:试管、胶头滴管
药品:新制氯水、新制溴水、溴化钠溶液、碘化钠溶液、四氯化碳
(3)实验内容(在下表横线中填写相关内容)
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈_____色 |
(4)实验结论:_________________________________。
(5)问题和讨论
①上述两个实验中发生反应的离子方程式分别为________________、__________________。
②由于氟单质过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯的强:______________、______________。
下列物质中,中心原子的杂化类型为sp3杂化的是
| A.C2H6 | B.C2H2 | C.BF3 | D.C2H4 |
 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。

 存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C
存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C 互为等电子体,O
互为等电子体,O