题目内容
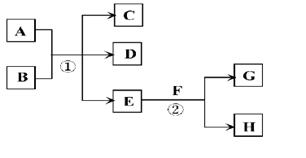
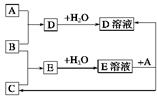
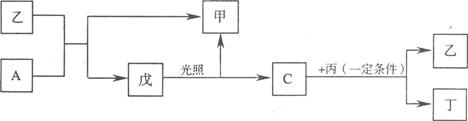
(15分)在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。
回答下列问题:
(1)写出H的电子式:
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是 。
①实验需要检验出C、D、E三种气体产物,三种气体检验的先后顺序是 (用化学式填空),在检验D气体前,需除去C气体,所用试剂是 ,反应的离子方程式是 。
②已知:A(s)+O2(g) =AO2(g) △H=-393.5kJ·mol-1
2A(s)+O2(g) =2AO(g) △H=-221.0kJ·mol-1
则AO的燃烧热的热化学方程式___________________________________.
③AO2在自然界循环时可与碳酸钙反应,碳酸钙是一种难溶物质,它的Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是 。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是 。

回答下列问题:
(1)写出H的电子式:
(2)若反应①在加热条件下进行,A为单质,C为无色有刺激性气味的气体,D为无色无味的气体,且C、D两种气体均能使澄清的石灰水变浑浊,则反应①的化学方程式是 。
①实验需要检验出C、D、E三种气体产物,三种气体检验的先后顺序是 (用化学式填空),在检验D气体前,需除去C气体,所用试剂是 ,反应的离子方程式是 。
②已知:A(s)+O2(g) =AO2(g) △H=-393.5kJ·mol-1
2A(s)+O2(g) =2AO(g) △H=-221.0kJ·mol-1
则AO的燃烧热的热化学方程式___________________________________.
③AO2在自然界循环时可与碳酸钙反应,碳酸钙是一种难溶物质,它的Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸产生能使品红溶液褪色的气体,在加热条件下,当A过量时,反应①的离子方程式是 。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是 。
(15分)(1)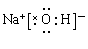 (1分)
(1分)
(2)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
①H2O、SO2、CO2 (1分),酸性KMnO4溶液(1分),
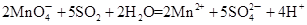 (2分)
(2分)
②CO(g)+ 1/2 O2(g)=CO2(g) △H=-283.0kJ·mol-1(2分)③5.6×10-5mol/L(2分)
(3)2OH-+NH4++HSO3- NH3↑+2H2O+SO32-(2分)
NH3↑+2H2O+SO32-(2分)
(4)4H++AlO2-=Al3++2H2O(2分)
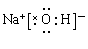 (1分)
(1分)(2)C+2H2SO4(浓)
 CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)①H2O、SO2、CO2 (1分),酸性KMnO4溶液(1分),
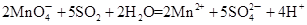 (2分)
(2分)②CO(g)+ 1/2 O2(g)=CO2(g) △H=-283.0kJ·mol-1(2分)③5.6×10-5mol/L(2分)
(3)2OH-+NH4++HSO3-
 NH3↑+2H2O+SO32-(2分)
NH3↑+2H2O+SO32-(2分)(4)4H++AlO2-=Al3++2H2O(2分)
本题是无机框图题,关键是找准突破点。
(1)E为常温下无色无味的液体,F为淡黄色粉末,所以E是水,F水过氧化钠。则G水氧气,H是氢氧化钠,其电子式是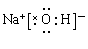 。
。
(2)根据物质的性质可判断,C是SO2,D是CO2。所以A是碳,B是浓硫酸,因此反应①的方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
①检验CO2用澄清的石灰水,SO2用品红溶液检验,水蒸气用无水硫酸铜检验。但由于SO2也能使澄清的石灰水反应,且通过溶液时会带出水蒸气,所以首先检验的是水蒸气、其次是SO2,最后是CO2。SO2具有还原性,可用酸性高锰酸钾溶液氧化而除去SO2,方程式为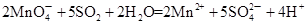 。
。
②燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。所以根据盖斯定律可知,CO燃烧热的热化学方程式为CO(g)+ 1/2 O2(g)=CO2(g) △H=-283.0kJ·mol-1。
③设生成沉淀所需CaCl2溶液的最小浓度为x,则混合后CO32-和Ca2+的浓度分别是1×10-4mol/L和0.5x。所以根据溶度积常数可知1×10-4×0.5x=2.8×10-9,解得x=5.6×10-5mol/L。
(3)根据B的性质可知,B是亚硫酸氢盐。由于D是一种气体,所以B是亚硫酸氢铵,因此方程式为2OH-+NH4++HSO3-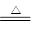 NH3↑+2H2O+SO32-。
NH3↑+2H2O+SO32-。
(4)B是一种含有两种金属元素的盐,且B的水溶液显碱性,这说明B是偏铝酸钠,所以反应的方程式为4H++AlO2-=Al3++2H2O.
(1)E为常温下无色无味的液体,F为淡黄色粉末,所以E是水,F水过氧化钠。则G水氧气,H是氢氧化钠,其电子式是
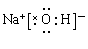 。
。(2)根据物质的性质可判断,C是SO2,D是CO2。所以A是碳,B是浓硫酸,因此反应①的方程式为C+2H2SO4(浓)
 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。①检验CO2用澄清的石灰水,SO2用品红溶液检验,水蒸气用无水硫酸铜检验。但由于SO2也能使澄清的石灰水反应,且通过溶液时会带出水蒸气,所以首先检验的是水蒸气、其次是SO2,最后是CO2。SO2具有还原性,可用酸性高锰酸钾溶液氧化而除去SO2,方程式为
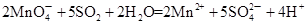 。
。②燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。所以根据盖斯定律可知,CO燃烧热的热化学方程式为CO(g)+ 1/2 O2(g)=CO2(g) △H=-283.0kJ·mol-1。
③设生成沉淀所需CaCl2溶液的最小浓度为x,则混合后CO32-和Ca2+的浓度分别是1×10-4mol/L和0.5x。所以根据溶度积常数可知1×10-4×0.5x=2.8×10-9,解得x=5.6×10-5mol/L。
(3)根据B的性质可知,B是亚硫酸氢盐。由于D是一种气体,所以B是亚硫酸氢铵,因此方程式为2OH-+NH4++HSO3-
 NH3↑+2H2O+SO32-。
NH3↑+2H2O+SO32-。(4)B是一种含有两种金属元素的盐,且B的水溶液显碱性,这说明B是偏铝酸钠,所以反应的方程式为4H++AlO2-=Al3++2H2O.

练习册系列答案
相关题目
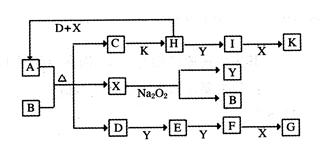
 cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。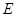 可以发生反应:2E+I
可以发生反应:2E+I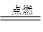 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.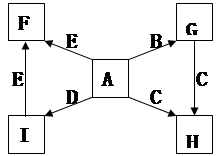
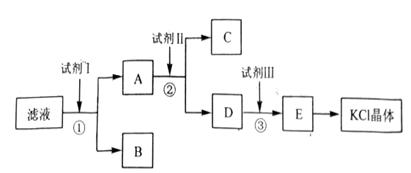
 (1)A、F的化学式分别为 、 。?
(1)A、F的化学式分别为 、 。?