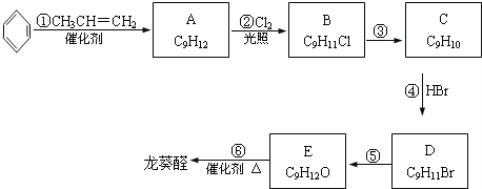
题目内容
【题目】金属及其化合物在人类生活、生产中发挥着重要的作用。
(1)下列物质中不属于合金的是_______。
A.钢 B.青铜 C.黄铜 D.水银
(2)在钠、铝、铁三种金属元素中,所形成的氧化物中适宜做耐火材料的是_______,向盛有硫酸铝溶液的试管中滴加足量氨水,反应的离子方程式是_____________。
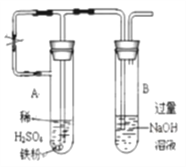
(3)乙同学为了获得持久白色的Fe(OH)2沉淀,准备用右图所示装置,用不含O2的蒸馏水配制的NaOH溶液与新制的FeSO4溶液反应。获得不含O2的蒸馏水的方法是_______。反应开始时,打开止水夹;一段时间后,关闭止水夹,在试管_______(填“A”或“B”)中观察到白色的Fe(OH)2。
(4)向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是____________。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
(5)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:__________;
(6)某研究性学习小组内测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是_______;②验证该溶液中含有Fe2+,正确的实验方法是_______;A.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+C.观察溶液是否呈浅绿色
【答案】 D Al2O3 Al3++3NH3·H2O=3NH4++Al(OH)3↓ 加热煮沸 B B 2Fe3++Cu=Cu2++2Fe2+ Fe3+ A
【解析】分析:(1)合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质。据此分析解答;
(2)氧化铝熔点较高,所以氧化铝可以作耐火材料;铝离子与氨水反应生成氢氧化铝沉淀;
(3)硫酸亚铁易被氧化而变质,应排除溶液中的氧气,可用加热溶液的方法除去溶解氧;A管中产生的气体通入B管中排尽A、B管中的空气,使A、B充满还原性气体氢气,可防止生成的氢氧化亚铁被氧化;试管B中为NaOH溶液,将A中液体压到B中与其反应;
(4)根据金属性Fe>Cu以及氧化性Fe3+>Cu2+>Fe2+分析;
(5)根据氯化铁与铜反应生成氯化亚铁和氯化铜解答;
(6)根据铁离子能与KSCN溶液反应显红色分析;根据亚铁离子的性质解答。
详解:(1)A.钢是铁与碳元素的合金,A错误;B.青铜是铜和锡的合金,B错误;C.黄铜是铜和锌的合金,C错误;D.水银为汞单质,不是混合物,不属于合金,D正确;答案选D;
(2)适合作耐火材料的氧化物必须具有高熔点,氧化铝的熔点较高,所以氧化铝可以作耐火材料;铝离子和氨水反应生成氢氧化铝沉淀和铵根,离子反应方程式为Al3++3NH3·H2O=3NH4++Al(OH)3↓;
(3)获得不含O2的蒸馏水的方法是煮沸,简单易操作;反应开始时,要打开止水夹,利用铁粉和稀硫酸反应产生的氢气排出试管A、B中的空气,使整个装置不含氧气。在对B试管的出气管排出的氢气验纯之后,关闭止水夹,由于产生的氢气无法排出,试管A中的压强将增大,最终将A试管中生成的FeSO4溶液压入NaOH溶液中,故Fe(OH)2在B试管生成;
(4)A.加入铁和铜的混合物,铁首先与氯化铁反应,可能铁全部反应而铜有剩余,A正确;B.加入铁和铜的混合物,铁首先与氯化铁反应,铜后参加反应,不会出现有铁无铜的情形,B错误;C.若氯化铁的量少,加入的铁粉和铜粉可能剩余,C正确;D.若氯化铁的量多,加入的铁粉和铜粉全部参加反应,不会有剩余,D正确;答案选B.
(5)氯化铁与铜反应生成氯化亚铁和氯化铜,反应的离子方程式为2Fe3++Cu=Cu2++2Fe2+;
(6)①取少量待测溶液,滴入KSCN溶液呈红色,该现象说明该溶液中含有的离子是Fe3+;②A.由于亚铁离子具有还原性,因此取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+,A正确;B.取适量溶液,滴入氯水,再滴入KSCN溶液,若显血红色,不能证明原溶液中含有Fe2+,因为原溶液中可能含有铁离子,B错误;C.观察溶液是否呈浅绿色,不能确定是否含亚铁离子,C错误,答案选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案