题目内容
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g)![]() 4NO2(g)+O2(g);△H>0
4NO2(g)+O2(g);△H>0
①如表为反应在T1 温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为____________________。
②在T 2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2________T1( 填>、<或=)。
(2)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。
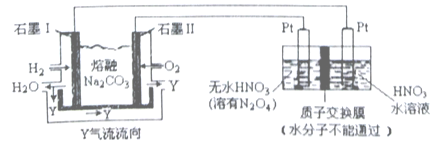
写出石墨Ⅰ电极上发生反应的电极反应式_____________________。N2O5 在电解池的_____________区生成(填“阳极”或“阴极”)。
【答案】 0.00296mol·L-1·s-1 < H2+CO32--2e-=H2O+CO2 阳极
【解析】(1). ①. 由表中数据可知,500s内N2O5的浓度变化量为△c(N2O5)=5mol/L3.52mol/L=1.48mol/L,故N2O5的分解速率为![]() =0.00296mol·L-1·s-1,故答案为:0.00296mol·L-1·s-1;
=0.00296mol·L-1·s-1,故答案为:0.00296mol·L-1·s-1;
②.在T2温度下,反应1000s时测得NO2的浓度为4.98molL1,则此时N2O5的浓度为5mol/L![]() ×4.98molL1=2.51mol/L,因该反应是吸热反应,高于在T1温度下1000s时N2O5的浓度2.48 mol/L,说明T2温度下反应逆向进行,故温度T2<T1,故答案为:<;
×4.98molL1=2.51mol/L,因该反应是吸热反应,高于在T1温度下1000s时N2O5的浓度2.48 mol/L,说明T2温度下反应逆向进行,故温度T2<T1,故答案为:<;
(2).原电池负极发生氧化反应,由装置图可知,负极上氢气失去电子,与熔融盐中碳酸根离子结合生成二氧化碳与水,负极电极反应式为:H2+CO322e═H2O+CO2,从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,故答案为:H2+CO322e═H2O+CO2;阳极。

【题目】已知:4HCl(g)+O2(g)2Cl2(g)+ 2H2O(g),该反应放出123kJ/mol的热量。其中相关的化学键键能数据如下:其中a的值为
化学键 | H—Cl | O=O | Cl—Cl | H—O |
E/(kJ/mol) | 431 | 497 | a | 465 |
A.242B.303.5C.180.5D.365