题目内容
【题目】(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有__。
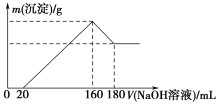
(Ⅱ)(3)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象:_______,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为__________________.
![]()
【答案】 ![]() SiO2、P4O10 溶液由浅绿色变红色 2:3
SiO2、P4O10 溶液由浅绿色变红色 2:3
【解析】(Ⅰ)(1)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,因为质子数和中子数之和是质量数,P元素的原子序数是15,中子数比质子数多1,所以质量数为15+15+1=31,所以表示该核素的原子符号为![]() ,故答案为:
,故答案为:![]() ;
;
(2)能和碱反应生成盐和水的氧化物是酸性氧化物,所以属于酸性氧化物的是SiO2、P4O10,故答案为:SiO2、P4O10;
(Ⅱ)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),亚铁离子通过阳离子交换膜进入左边被盐酸酸化的H2O2氧化,铁离子通过阳离子交换膜进入右边与KSCN溶液接触,溶液变成血红色,离子方程式为:2H++2Fe2++H2O2=2H2O+2Fe3+,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42-通过交换膜时(若反应迅速完全),当有2mol SO42-通过交换膜时,根据电荷守恒则有4molOH-进入左室,左室生成氢氧化铝![]() mol,右室生成2mol硫酸钡,则左右两室沉淀的物质的量之比为2:3;故答案为:溶液由浅绿色变红色;2:3。
mol,右室生成2mol硫酸钡,则左右两室沉淀的物质的量之比为2:3;故答案为:溶液由浅绿色变红色;2:3。

【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g)![]() 4NO2(g)+O2(g);△H>0
4NO2(g)+O2(g);△H>0
①如表为反应在T1 温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为____________________。
②在T 2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2________T1( 填>、<或=)。
(2)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。
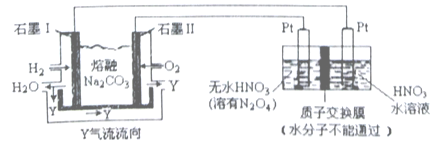
写出石墨Ⅰ电极上发生反应的电极反应式_____________________。N2O5 在电解池的_____________区生成(填“阳极”或“阴极”)。