题目内容
【题目】科学家哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室制取氨气的化学方程式_________。检验氨气已装满的方法是________。
(2)氨气可用如图装置进行喷泉实验,把氨气换成______(填序号)也可形成喷泉实验。
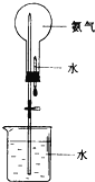
A.二氧化碳 B.氧气 C.氯化氢气体 D.氢气
(3)完成氨催化氧化生成为NO的反应方程式,4NH3+____O2===4NO+6_____,产物NO能在通常状况下被空气氧化为NO2,请完成下列反应生成硝酸的化学方程式:4NO+__O2+2H2O===4HNO3,___NO2+____O2 +__H2O===4HNO3
(4)12.8 g Cu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为_______mol。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 湿润的红色石蕊试纸放在瓶口,看试纸是否变蓝或者用玻璃棒醮浓HCl放在瓶口看是否冒白烟 C 4NH3+5O2=4NO+6H2O 4NO+3O2+2H2O=4HNO3 4NO2+1O2+2H2O=4HNO3 0.1
CaCl2+2NH3↑+2H2O 湿润的红色石蕊试纸放在瓶口,看试纸是否变蓝或者用玻璃棒醮浓HCl放在瓶口看是否冒白烟 C 4NH3+5O2=4NO+6H2O 4NO+3O2+2H2O=4HNO3 4NO2+1O2+2H2O=4HNO3 0.1
【解析】
(1)氯化铵和熟石灰在加热条件下反应生成氨气、氯化钙和水,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;氨气为碱性气体,与水反应生成NH3H2O,NH3H2O电离出OH-离子,溶液呈碱性,用湿润的红色石蕊试纸靠近集气瓶口,如果试纸变蓝,则氨气已满,或者用玻璃棒醮浓HCl放在瓶口,如果立即冒白烟,说明已经收集满;
CaCl2+2NH3↑+2H2O;氨气为碱性气体,与水反应生成NH3H2O,NH3H2O电离出OH-离子,溶液呈碱性,用湿润的红色石蕊试纸靠近集气瓶口,如果试纸变蓝,则氨气已满,或者用玻璃棒醮浓HCl放在瓶口,如果立即冒白烟,说明已经收集满;
(2)二氧化碳在水中的溶解度很小,氧气、氢气难溶于水,均不能形成喷泉;氯化氢气体极易溶于水,能形成喷泉。答案选C。
(3)氨气催化氧化生成一氧化氮和水,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O,一氧化氮和氧气混合通入水中恰好反应生成硝酸,反应的化学方程式为4NO+3O2+2H2O=4HNO3,二氧化氮和氧气混合通入水中完全吸收得到硝酸,反应的化学方程式为4NO2+O2+2H2O=4HNO3;
4NO+6H2O,一氧化氮和氧气混合通入水中恰好反应生成硝酸,反应的化学方程式为4NO+3O2+2H2O=4HNO3,二氧化氮和氧气混合通入水中完全吸收得到硝酸,反应的化学方程式为4NO2+O2+2H2O=4HNO3;
(4)12.8gCu物质的量为12.8g÷64g/mol=0.2mol,与足量的浓硝酸反应生成的气体和氧气通入水中恰好反应无气体剩余生成硝酸,这说明铜失去的电子最终被氧气获得,0.2mol铜失去0.4mol电子,1分子氧气得到4个电子,则根据电子得失守恒可知需要氧气物质的量为0.4mol÷4=0.1mol。

【题目】某同学用某种粗盐进行提纯实验,步骤如下图所示。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是__________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ________ | 猜想Ⅰ 成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | ________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,________ | ________ | 猜想Ⅲ 成立 |
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:N2O5(g)![]() 4NO2(g)+O2(g);△H>0
4NO2(g)+O2(g);△H>0
①如表为反应在T1 温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为____________________。
②在T 2温度下,反应1000s时测得NO2的浓度为4.98 mol·L-1,则T2________T1( 填>、<或=)。
(2)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2。
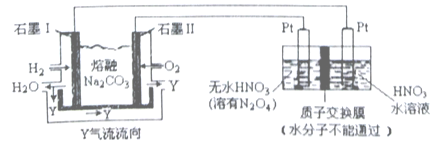
写出石墨Ⅰ电极上发生反应的电极反应式_____________________。N2O5 在电解池的_____________区生成(填“阳极”或“阴极”)。
【题目】严重的雾霾天气,给人们的出行及身体造成了极大的危害,研究NO2、SO2、CO等大气污染气体的形成及处理具有重要意义。
(1)500℃时,在催化剂存在条件下,分别将2molSO2和1molO2置于恒压容器甲和恒容容器乙中(两容器起始容积相同),充分反应,二者均达到平衡后:
①两容器中SO2的转化率关系是甲_____乙(填“>”、“<”或“=”)。
②在容器乙中,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,充入1molSO3 d.在其他条件不变时,改用高效催化剂
(2)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_______________。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显_____性(填“酸”、“碱”或“中”),用化学平衡原理解释:________。
(3)用CH4催化剂还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用标准状况下4.48CH4还原NO2至N2,整个过程中转移的电子总数为_____(阿伏加德罗常数的值用NA表示),放出的热量为_______kJ。
(4)工业上合成氨所需氢气的制备过程中,其中的一步反应为:CO(g)+H2O(g)====CO2(g)+H2(g) △H<0。一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6.则平衡常数K=______(计算结果保留两位小数)。