题目内容
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的![]() 元素的基态原子核外电子排布式:____________________。
元素的基态原子核外电子排布式:____________________。
(2)立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是______________________。
(3)![]() 分子中中心原子的杂化轨道类型是_________________,
分子中中心原子的杂化轨道类型是_________________,![]() 微粒的空间构型是_____________。
微粒的空间构型是_____________。
(4)![]() 被认为是有机化学中的“万能还原剂”,
被认为是有机化学中的“万能还原剂”,![]() 的电子式为_____________,其中三种元素的电负性由大到小的顺序是_____________________。
的电子式为_____________,其中三种元素的电负性由大到小的顺序是_____________________。
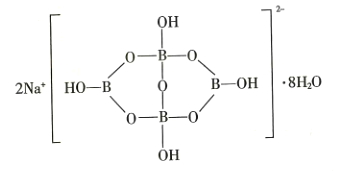
(5)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作![]() ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个![]() 和两个
和两个![]() 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成![]() ,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是_______________(填字母)。
,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是_______________(填字母)。
A.离子键 B.共价键 C.氢键 D.金属键 E.范德华力

(6)磷化硼的晶胞如图所示,其化学式为____________,若晶胞中硼原子与磷原子之间的最近核间距为apm,则晶胞边长为____________cm。
【答案】![]()
![]() 的键长比
的键长比![]() 的键长短(或
的键长短(或![]() 的键能较大)
的键能较大) ![]() 杂化 正四面体
杂化 正四面体 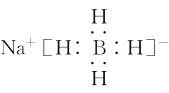
![]() D BP
D BP ![]()
【解析】
(1)Ga元素与B元素同主族,则其价电子排布为4s24p1,内层排满,所以电子排布为[Ar]3d104s24p1;
(2)原子晶体的硬度和耐热性与共价键强弱有关,B、N原子半径比Si原子半径小,B-N键比Si-Si键键长短,键能更大;
(3)BF3中心原子的价层电子对数为![]() =3,所以为sp2杂化;SiF4的中心原子的价层电子对数为
=3,所以为sp2杂化;SiF4的中心原子的价层电子对数为![]() =4,不含孤电子对,所以空间构型为正四面体;
=4,不含孤电子对,所以空间构型为正四面体;
(4)NaBH4是离子化合物,钠离子为阳离子,故NaBH4的电子式为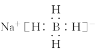 ;NaBH4中化合价Na为金属;故Na的电负性最小,后两种为非金属,B和H形成共价键;氢元素显负价,吸引电子能力更强;故元素的电负性大小顺序为:H>B>Na;
;NaBH4中化合价Na为金属;故Na的电负性最小,后两种为非金属,B和H形成共价键;氢元素显负价,吸引电子能力更强;故元素的电负性大小顺序为:H>B>Na;
(5)Na2B4O710H2O该盐中存在阴阳离子间的离子键、B和O原子之间存在共价键和配位键,水分子间存在氢键和范德华力,该物质中不含金属键,应选D项;
(6)根据均摊法,晶胞中B原子的个数为![]() =4;P原子的个数为4,所以化学式为BP;根据晶胞结构可知P原子和周围的4个B原子形成正四面体结构,根据几何知识可知B原子和P原子之间的最近距离为体对角线的
=4;P原子的个数为4,所以化学式为BP;根据晶胞结构可知P原子和周围的4个B原子形成正四面体结构,根据几何知识可知B原子和P原子之间的最近距离为体对角线的![]() ,设晶胞的边长为x,则有
,设晶胞的边长为x,则有![]() pm,所以x=
pm,所以x=![]() cm。
cm。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案