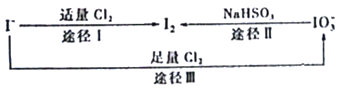
题目内容
【题目】一定温度下,向某密闭容器中加入0.2 mol CO和0.2 mol H2O,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
CO2(g)+H2(g),4 min时反应达到平衡状态,测得n(CO)∶n(CO2)=3∶2,下列说法正确的是
A.缩小容器的体积,混合气体的密度不变
B.v(CO)=v(CO2)时,表明反应达到平衡状态
C.平衡时CO和H2O的转化率相等
D.无法计算该条件下反应的化学平衡常数
【答案】C
【解析】缩小容器的体积,化学平衡不移动,但混合气体的密度变大,A项错误;v(CO)=v(CO2)指的是同一反应方向,不能表示反应已达到平衡状态,B项错误;由于起始充料的量之比与方程式中反应物的化学计量数之比一致,故各反应物的转化率一样,C项正确;由化学平衡常数表达式K===,而根据题意可求出达到平衡状态时,反应体系中CO、H2O、CO2、H2的物质的量,则可求出其平衡常数,D项错误。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:
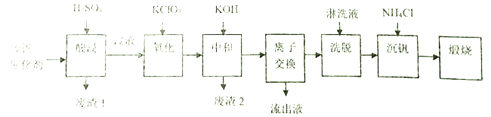
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。