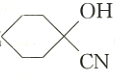
题目内容
【题目】(1)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是_____________,CO的体积分数是_____________,该混合气体对于氢气的相对密度为________ 。
(2) 1.12g金属铁跟某稀盐酸恰好完全反应,得到100mL溶液,试计算:
①生成的气体在标准状况下的体积是_________________
②反应后所得溶液中溶质的物质的量浓度是______________________
【答案】1:3 25% 20 0.448L或448ml 0.2mol/L
【解析】
(1)设CO和CO2的物质的量分别为x、y,则
x+y=![]()
28x+44y=16;
(2)根据方程式计算。
(1)设CO和CO2的物质的量分别为x、y,则
x+y=![]()
28x+44y=16;
解得x=0.1mol,y=0.3mol,
则CO和CO2的物质的量之比是0.1mol:0.3mol=1:3,
CO的体积分数是![]() ×100%=25%,
×100%=25%,
混合气体的平均摩尔质量是![]() =40g·mol-1,该混合气体对于氢气的相对密度为40÷2=20;
=40g·mol-1,该混合气体对于氢气的相对密度为40÷2=20;
(2)Fe+2HCl=FeCl2+H2↑
56g 1mol 22.4L
1.12g n(FeCl2) V(H2)
![]() =
=![]() =
=![]()
解得n(FeCl2)=0.02mol V(H2)=0.448L
①生成的气体在标准状况下的体积是V(H2)=0.448L;
②n(FeCl2)=0.02mol,反应后所得溶液中溶质的物质的量浓度是0.02mol÷0.1L=0.2mol·L-1。

【题目】实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 取一定量固体溶解,向溶液中通入足量的CO,观察到有晶体析出 | 原固体中一定含Na2CO3 |
B | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成 | 原固体中一定含有Na2CO3 |
C | 取一定量固体,溶解,向溶液中滴加适量AgNO3 溶液,观察有白色沉淀生成 | 原固体中一定含有NaCl |
D | 称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到有0.88g气体 | 原固体中三种物质都有 |
A.AB.BC.CD.D