题目内容
18.下列有关实验的说法不正确的是( )| A. | 测定中和热实验的玻璃仪器只需烧杯、量筒和温度计 | |
| B. | 用25mL碱式滴定管量取13.50mL Na2CO3溶液 | |
| C. | 用10mL量筒量取5.5mL硫酸溶液 | |
| D. | 用广泛pH试纸不能测得某碱溶液的pH为12.7 |
分析 A.缺少环形玻璃搅拌捧;
B.滴定管精确到0.01;
C.量筒精确到0.1;
D.广泛pH试纸只能为整数.
解答 解:A.中和热的测定实验中需要用的主要玻璃仪器有:二只大小不同的烧杯、二只大小相同的量筒、温度计、环形玻璃搅拌捧,故A错误;
B.滴定管精确到0.01,可量取13.50mL Na2CO3溶液,故B正确;
C.量筒精确到0.1,可量取5.5mL硫酸溶液,故C正确;
D.广泛pH试纸只能为整数,不能测出12.7,故D正确.
故选A.
点评 本题考查了仪器的使用,难度不大,明确常见仪器的感量是解本题关键,这类知识点是易错点,也是常考查点.

练习册系列答案
相关题目
8.X元素最高价氧化物对应的水化物为HXO3,其气态氢化物为( )
| A. | HX | B. | XH3 | C. | H2X | D. | XH4 |
13.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )
| A. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 | |
| B. | 甲、乙氢氧化物溶液的碱性:甲>乙 | |
| C. | 乙能与盐酸反应放出H2,而甲不能 | |
| D. | 将甲、乙作电极组成原电池时,甲为正极 |
3.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 2.4gMg溶于足量稀盐酸,转移的电子数为0.1NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 的数目为NA |
7.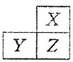 X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
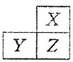 X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | 原子半径:X>Y>Z | |
| B. | 气态氢化物的热稳定性:X<Z | |
| C. | Y和Z的最高价氧化物对应水化物均为强酸 | |
| D. | X和Z形成的化合物只有共价键 |
 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.