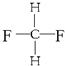
题目内容
13.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )| A. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 | |
| B. | 甲、乙氢氧化物溶液的碱性:甲>乙 | |
| C. | 乙能与盐酸反应放出H2,而甲不能 | |
| D. | 将甲、乙作电极组成原电池时,甲为正极 |
分析 金属的金属性越强,其最高价氧化物的水化物碱性越强,金属单质的还原性越强,其单质与水或酸反应越剧烈,据此分析解答.
解答 解:A.金属的金属性强弱与失电子多少无关,如等物质的量的Al、Mg分别和足量稀盐酸反应,铝失电子多,但金属性Mg>Al,故A错误;
B.金属的金属性越强,其最高价氧化物的水化物碱性越强,甲、乙氢氧化物溶液的碱性:甲>乙,则金属性甲>乙,故B正确;
C.乙能与盐酸反应放出H2,而甲不能,则金属性甲<乙,故C错误;
D.一般来说,原电池中较活泼金属作负极、较不活泼金属作正极,将甲、乙作电极组成原电池时,甲为正极,则金属性甲<乙,故D错误;
故选B.
点评 本题考查金属性强弱判断,为高频考点,明确金属性强弱判断方法是解本题关键,注意金属的金属性强弱与失电子难易程度有关,与失电子多少无关,易错选项是A.

练习册系列答案
相关题目
4.正确的实验操作是实验成功的重要因素,下列实验操作正确的是( )
| A. | 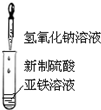 制备氢氧化亚铁并观察其颜色 | B. | 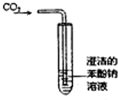 碳酸、苯酚酸性强弱比较 | ||
| C. | 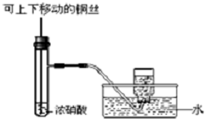 制备并收集少量NO2气体 | D. | 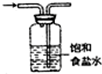 除去氯气中氯化氢 |
1.在一定温度下,可逆反应X(g)+3Y(g)?2Z(g)达到平衡的标志是( )
| A. | X、Y、Z的浓度不再变化 | |
| B. | 单位时间生成a mol X,同时生成3a mol Y | |
| C. | X、Y、Z的分子数比为1:3:2 | |
| D. | Z生成的速率与X生成的速率相等 |
18.下列有关实验的说法不正确的是( )
| A. | 测定中和热实验的玻璃仪器只需烧杯、量筒和温度计 | |
| B. | 用25mL碱式滴定管量取13.50mL Na2CO3溶液 | |
| C. | 用10mL量筒量取5.5mL硫酸溶液 | |
| D. | 用广泛pH试纸不能测得某碱溶液的pH为12.7 |
5.在氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂.下列反应中属于氧化还反应且与Br2+SO2+2H2O═H2SO4+2HBr相比较,水的作用相同的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | CaO+H2O═Ca(OH)2 |
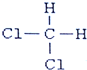 和
和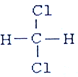
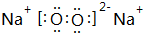 ,Z的化学式SiO2;
,Z的化学式SiO2;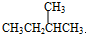 与
与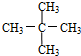 G.
G.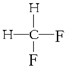 与
与