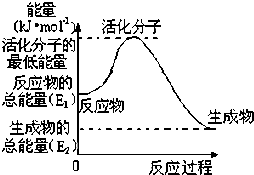
题目内容
13.某物质A在一定条件下加热完全分解,产物都是气体,分解方程式为:2A=B+C+2D.测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )| A. | 8d | B. | 4d | C. | 2.5d | D. | 2d |
分析 由2A=B+C+2D可知,2molA分解生成4mol气体,生成的混合气体对氢气的相对密度为d,则混合气体的平均摩尔质量为2d,结合M=$\frac{m}{n}$计算.
解答 解:由2A=B+C+2D可知,2molA分解生成4mol气体,生成的混合气体对氢气的相对密度为d,则混合气体的平均摩尔质量为2d,
设A为2mol,由质量守恒可知,A的质量为4mol×2dg/mol=8dg,
A的摩尔质量为$\frac{8dg}{2mol}$=4dg/mol,则A的相对分子质量为4d,
故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握质量守恒及物质的量与质量的关系为解答的关键,侧重分析与计算能力的考查,注意混合气体的摩尔质量计算,题目难度不大.

练习册系列答案
相关题目
4.已知0.1mol/L的CH3COOH(aq)中存在电离平衡:CH3COOH?CH3COO-+H+ 要使溶液c(H+):c (CH3COOH) 可能变大,可以使用的方法是( )
| A. | 加入少量NaOH(s) | B. | 加入CH3COONa(s) | C. | 加入少量冰醋酸 | D. | 不断加入食盐水 |
8.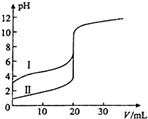 室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00ml 0.100mol•L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )
室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00ml 0.100mol•L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )
 室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00ml 0.100mol•L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )
室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00ml 0.100mol•L-1 的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是( )| A. | Ⅱ表示的是滴定盐酸的曲线 | |
| B. | PH=7时,滴定盐酸消耗V(NaOH)大于滴定醋酸消耗V(NaOH) | |
| C. | V(NaOH)=20ml时,C(Cl-)═C(CH3COO-) | |
| D. | V(NaOH)=10ml时,醋酸溶液中:C(CH3COO- )>C(Na+ )>C(H+)>C(OH-) |
2.同温同压下两个容积相等的贮气瓶,一个装有NO气体,另一个装有N2和O2的混合气体,两瓶内的气体一定具有相同的( )
| A. | 质量 | B. | 原子总数 | C. | 质子总数 | D. | 密度 |
3.下列化学反应中,离子方程式表示正确的是( )
| A. | 石灰石溶解在稀HCl中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁屑在稀H2SO4作用下产生H2:Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应:H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀:SO42-+Ba2+═BaSO4↓ |