题目内容
【题目】电解原理在化学工业中有广泛应用。
(1)利用下图装置电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
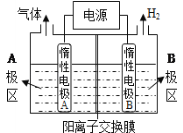
①B极区电解液为__________溶液(填化学式),A极要连接电源的________(填“正”或“负”)极。
②阳极电极反应式为______________________________________,电解过程中Na+向____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是_____________________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
①若X为碳电极,为减缓铁的腐蚀,开关K应置于________处。(填“A”、“B”或“C”)
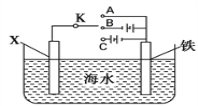
②若X为锌电极,开关K置于A处,该电化学防护法称为______________________。
(3)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O![]() V2++VO2++2H+。放电时的正极反应式为___________________________充电时的阴极反应式为______________________________。放电过程中,电解液的pH________(选填“升高”“降低”或“不变”)。
V2++VO2++2H+。放电时的正极反应式为___________________________充电时的阴极反应式为______________________________。放电过程中,电解液的pH________(选填“升高”“降低”或“不变”)。
【答案】NaOH 正2Cl—2e=Cl2↑B2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-C牺牲阳极的阴极保护法VO2++2H++e-═VO2++H2OV3++e-═V2+升高
Cl2↑+H2↑+2OH-C牺牲阳极的阴极保护法VO2++2H++e-═VO2++H2OV3++e-═V2+升高
【解析】
(1)电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备NaOH,B极区电解液为NaOH溶液;Na+由A经过阳离子交换膜向B移动;A中为NaCl溶液,氯离子放电生成氯气,则阳极反应式为2Cl--2e-=Cl2↑;
①根据图示可知,B极有氢气产生,为电解池的阴极,B极区电解液为NaOH溶液,A极为电解池的阳极要连接电源的正极;正确答案:NaOH;正。
②阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Na+向B电极迁移;正确答案:2Cl--2e-=Cl2↑;B。
③电解饱和食盐水生成氯化钠、氯气和氢气,总反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;正确答案:2Cl-+2H2O
Cl2↑+H2↑+2OH-;正确答案:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)①若X为碳棒,开关K应置于A处,构成原电池,Fe为负极,加速Fe的腐蚀;开关K应置于B处,构成电解池,Fe为阳极,加速铁的腐蚀;开关K应置于C处,构成电解池,Fe为阴极,被保护,减缓铁的腐蚀;正确答案:C。
②若X为锌,开关K应置于A处,构成原电池,Zn为负极,Fe被保护,减缓铁的腐蚀,该方法为牺牲阳极的阴极保护法;正确答案:牺牲阳极的阴极保护法。
(3)正极反应是还原反应,由电池总反应可知放电时的正极反应为VO2++2H++e-![]() VO2++H2O;电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应,极反应为:V3++e-═V2+;放电为原电池,总反应为V2++VO2++2H+=VO2++V3++H2O,氢离子浓度减小,酸性减小,电解液的pH升高;正确答案:VO2++2H++e-═VO2++H2O;V3++e-═V2+;升高。
VO2++H2O;电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应,极反应为:V3++e-═V2+;放电为原电池,总反应为V2++VO2++2H+=VO2++V3++H2O,氢离子浓度减小,酸性减小,电解液的pH升高;正确答案:VO2++2H++e-═VO2++H2O;V3++e-═V2+;升高。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑧ | ⑩ | ||||||
3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
4 | ② | ④ |
(1)写出下列序号所代表的元素符号③_____;⑩______
(2)写出⑥的一种用途_________________;常温下可与表中_______单质反应(填化学式
(3)元素④的原子结构示意图为________________________;
(4)⑤和⑨形成的化合物的化学式为:_____________;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________.
(5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________(用元素符号表示)
(6)将①⑤同时投入到水中,发生反应的化学方程式有:______________