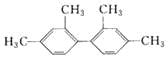
题目内容
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 标准状况下,2.8 g 14C18O中质子数为1.4NA
B. 常温下,0.3 mol NO2通入水中完全反应,转移的电子数为0.2NA
C. CO燃烧热为283.0 kJ/mol,若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为NA
D. 62.0 g乙二醇中含有的羟基数目为NA
【答案】B
【解析】
A. 标准状况下,2.8 g是0.875mol,1mol 14C18O中的质子数为14NA,则2.8 g 14C18O中质子数为0.875mol![]() 14NA=1.2,故A错误;B. 常温下,由3NO2+H2O=2HNO3+NO,3mol NO2转移2mol, 0.3 mol NO2通入水中完全反应,转移的电子数为0.2NA,故B正确;C. CO燃烧热为283.0 kJ/mol,CO(g)+1/2O2(g)= CO2(g)若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为1/2NA,故C错误;D. 62.0 g乙二醇是1mol,含有的羟基数目为2NA,故D错误;答案:B。
14NA=1.2,故A错误;B. 常温下,由3NO2+H2O=2HNO3+NO,3mol NO2转移2mol, 0.3 mol NO2通入水中完全反应,转移的电子数为0.2NA,故B正确;C. CO燃烧热为283.0 kJ/mol,CO(g)+1/2O2(g)= CO2(g)若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为1/2NA,故C错误;D. 62.0 g乙二醇是1mol,含有的羟基数目为2NA,故D错误;答案:B。

【题目】液氨作为一种潜在的清洁汽车燃料已越来越被重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。
(1)氨的燃烧实验涉及下列两个相关的反应:
①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(l) ΔH2
则4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的ΔH=_____。(请用含有ΔH1、ΔH2的式子表示)
(2)氨气可以直接用于燃料电池,选择碱性溶液作为电解质溶液,写出负极的电极反应式__________。
(3)已知合成氨反应的方程式为N2+3H2![]() 2NH3,其平衡常数K的数值和温度的关系如下:
2NH3,其平衡常数K的数值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.00 | 0.86 | 0.50 |
①由上表数据可知该反应ΔH______0(填“>”或“<”)。
②400℃时,测得某时刻c(N2)=1 mol·L-1、c(H2)=3 mol·L-1、c(NH3)=2 mol·L-1,此时刻该反应的v正____v逆(填“>”“=”或“<”)。
(4)下图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后合成NH3,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①曲线a对应的温度是__________________。
②关于合成氨的反应,下列叙述正确的是________。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 图中M、Q点平衡常数K的关系是K(M)>K(Q)
③M点对应的H2的转化率是____________________。
④400℃时,将1mol N2和3mol H2充入恒压密闭容器中,下图分别代表焓变(ΔH)、混合气体平均相对分子质量(M)、N2质量分数[φ(N2)]和混合气体密度(ρ)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是_____________________。