题目内容
(15分)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。某校化学兴趣小组的同学为确定该方法所得固体的成分,称取该固体四份,溶于水后,分别逐滴加入相同浓度的硫酸溶液50 mL,产生SO2的体积(标准状况)如下表(实验时设法使水中溶解的SO2几乎完全逸出):
⑴上述四组实验中,SO2体积与固体的质量之比相同的组别有__________________;由第①组实验中的SO2体积与固体的质量之比,可以推算用6.945 g该固体进行同样的实验时,产生SO2_________mL(标准状况);根据表中 两组数据变化可确认该固体中一定含有(NH4)2SO3。
⑵另取9.260 g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136 mL,则该固体的成分除(NH4)2SO3外还有___________(填化学式),该实验中使用的硫酸的物质的量浓度为_______________。
| 实验组别 | ① | ② | ③ | ④ |
| 硫酸溶液的体积(mL) | 50 | 50 | 50 | 50 |
| 盐的质量(g) | 9.260 | 13.890 | 20.835 | 32.410 |
| 二氧化硫的体积(mL) | 1344 | 2016 | 3024 | 2464 |
⑵另取9.260 g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136 mL,则该固体的成分除(NH4)2SO3外还有___________(填化学式),该实验中使用的硫酸的物质的量浓度为_______________。
⑴①②③;1008 mL;③④;(每空3分,共9分)
⑵(NH4)2SO4、NH4HSO3; 2.5 mol?L-1(共6分)
⑵(NH4)2SO4、NH4HSO3; 2.5 mol?L-1(共6分)
(1)根据表中数据可知①②③中SO2体积与固体的质量之比相同,都是根据第①组实验中的SO2体积与固体的质量之比可知,6.945 g该固体生成的SO2是6.945 g/9.260g×1344ml=1008 mL;根据③④可知,增加固体的质量,生成上网SO2反而减少,这说明固体中一定含有亚硫酸铵。由于亚硫酸铵与酸反应是分步进行的,如果酸不足,则生成的SO2就少。
(2)解法一:设9.260 g固体中(NH4)2SO3、NH4HSO3、(NH4)2SO4的物质的量分别为x、y、z
则 x + y =" 0.06" 2x + y +z = 0.14 116x + 99y + 132z =" 9.26" g
解得:x =" 0.04" mol y =" 0.02" mol z="0.02" mol
第④组固体质量是第①组固体质量3.5倍,则第④组固体中(NH4)2SO3、NH4HSO3、(NH4)2SO4的物质的量分别为0.14 mol、0.07 mol、0.07 mol
消耗的硫酸的物质的量:n(H2SO4)= [n((NH4)2SO3)+n(SO2)]=
[n((NH4)2SO3)+n(SO2)]= (0.14 mol+
(0.14 mol+ )="0.125" mol
)="0.125" mol
则c(H2SO4)=" 2.5" mol?L-1
解法二:第④组中硫酸一定没有剩余,反应后所得溶液中含(NH4)2SO4和NH4HSO3
第④组中固体含S为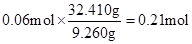 含NH4+的0.14 mol×3.5 =" 0.49" mol
含NH4+的0.14 mol×3.5 =" 0.49" mol
反应后所得溶液中含NH4HSO3为: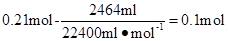
则据电荷守恒得,所得溶液中含SO42—的物质的量为:(0.49 mol-0.1 mol)/2="0.195" mol
原固体中含(NH4)2SO4的0.02 mol×3.5 =" 0.07" mol
∴H2SO4的物质的量为0.195 mol-0.07 mol =" 0.125" mol ∴c(H2SO4)=" 2.5" mol?L-1(其他合理解法均给分)
(2)解法一:设9.260 g固体中(NH4)2SO3、NH4HSO3、(NH4)2SO4的物质的量分别为x、y、z
则 x + y =" 0.06" 2x + y +z = 0.14 116x + 99y + 132z =" 9.26" g
解得:x =" 0.04" mol y =" 0.02" mol z="0.02" mol
第④组固体质量是第①组固体质量3.5倍,则第④组固体中(NH4)2SO3、NH4HSO3、(NH4)2SO4的物质的量分别为0.14 mol、0.07 mol、0.07 mol
消耗的硫酸的物质的量:n(H2SO4)=
 [n((NH4)2SO3)+n(SO2)]=
[n((NH4)2SO3)+n(SO2)]= (0.14 mol+
(0.14 mol+ )="0.125" mol
)="0.125" mol则c(H2SO4)=" 2.5" mol?L-1
解法二:第④组中硫酸一定没有剩余,反应后所得溶液中含(NH4)2SO4和NH4HSO3
第④组中固体含S为
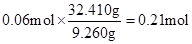 含NH4+的0.14 mol×3.5 =" 0.49" mol
含NH4+的0.14 mol×3.5 =" 0.49" mol反应后所得溶液中含NH4HSO3为:
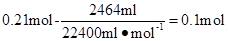
则据电荷守恒得,所得溶液中含SO42—的物质的量为:(0.49 mol-0.1 mol)/2="0.195" mol
原固体中含(NH4)2SO4的0.02 mol×3.5 =" 0.07" mol
∴H2SO4的物质的量为0.195 mol-0.07 mol =" 0.125" mol ∴c(H2SO4)=" 2.5" mol?L-1(其他合理解法均给分)

练习册系列答案
相关题目
 Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是
Fe2O3+SO2↑+ SO3↑+ 14H2O,将生成的气体通入BaCl2溶液中,下列叙述中正确的是