题目内容
【题目】高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和医疗上有非常广泛的应用。以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:
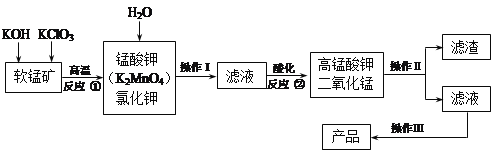
(1)操作Ⅱ的名称是_______,实验室进行该操作须用到的玻璃仪器有 ;
(2)反应②的产物中,氧化产物与还原产物的物质的 量之比是______;
(3)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
a.稀盐酸 b.稀硫酸 c.稀醋酸
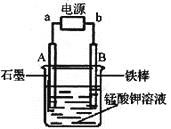
(4)电解锰酸钾溶液也可以制备高锰酸钾,其阴极反应式为:2H2O + 2e-= 2OH-+ H2↑,如图,b为电源的_______极,电解池的阳极反应式是_______;若电解过程中收集到2.24 L H2(标准状况),则得到高锰酸钾______g。(提示:阴离子放电顺序MnO42->OH-)
【答案】(1)过滤 (1分) 烧杯、漏斗、玻璃棒(2分)
(2)2∶1 (2分)
(3)a(2分)
(4)负(1分) MnO42-– e-="=" MnO4-(3分) 31.6 (3分)
【解析】试题分析:(2)锰酸钾酸化后生成高锰酸钾和二氧化锰,实际上是发生了一个歧化反应:
K2MnO4![]() K2MnO4+MnO2;依据电子守恒可知,氧化产物K2MnO4与还原产物MnO2之比为:2∶1;(3)因为盐酸中的氯具有还原性,高锰酸钾可以将它氧化,从而消耗掉高锰酸钾。(4)b必须为电源的负极,若为正极的话,铁就会参与电极反应。
K2MnO4+MnO2;依据电子守恒可知,氧化产物K2MnO4与还原产物MnO2之比为:2∶1;(3)因为盐酸中的氯具有还原性,高锰酸钾可以将它氧化,从而消耗掉高锰酸钾。(4)b必须为电源的负极,若为正极的话,铁就会参与电极反应。

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目