题目内容
常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是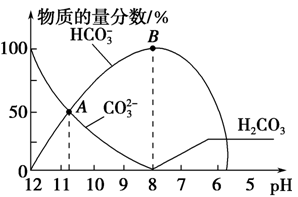
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+ c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 ml |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
C
解析试题分析: A、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故A错误;B、当混合溶液体积为20mL时,二者恰好反应生成NaHCO3,HCO3-的电离程度小于其水解程度,所以其溶液呈碱性,要使混合溶液呈中性,则酸稍微过量,所以混合溶液体积稍微大于20mL,故B错误;C、根据物料守恒得c(Na+)浓度最大,故C正确;D、根据图象分析,A点为碳酸钠和碳酸氢钠的混合溶液,且c(HCO3-)=c(CO32-),溶液呈碱性,则c(OH-)>c( H+),盐溶液水解程度较小,所以c(CO32-)>c(OH-),则离子浓度大小顺序是c(HCO3-)=c(CO32-)>c(OH-)>c( H+),故D不正确,答案选C。
考点:考查溶液酸碱性判断以及离子浓度大小比较等

 阅读快车系列答案
阅读快车系列答案某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
| A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH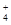 )之和 )之和 |
在蒸发皿中加热蒸干再加热(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
| A.氯化铝 | B.碳酸氢钠 | C.硫酸亚铁 | D.硫酸镁 |
常温时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.饱和碳酸钠溶液中:c(Na+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3) |
| B.pH=2的醋酸中:c(H+)=0.02mol?L-1 |
| C.0.1 mol?L-1氯化铵溶液中:c(H+)> c(OH-)> c(Cl-)> c(NH4+) |
| D.pH=12的NaOH溶液与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+) = c(NH4+) |
常温下,关于1L pH=3的H2SO4溶液说法正确的是
| A.与等体积pH=11氨水混合后所得溶液pH小于7 |
| B.与等浓度的CH3COONa溶液混合后所得溶液pH一定小于7 |
| C.与pH=3的CH3COOH溶液混合后所得溶液pH小于3 |
| D.与10L Ba(OH)2溶液恰好完全反应,则Ba(OH)2溶液的pH一定等于10 |
下列叙述不正确的是
| A.向纯水中加入少量CH3COONa固体,促进了水的电离 |
| B.25°C 时,pH=3的醋酸与pH=3的HCl对水的电离抑制作用相同 |
| C.25°C时,pH=3的NH4Cl溶液中,水电离出的c(H+)是10-3mol/L |
| D.升高温度,纯水电离出的c(H+)增大,pH减少,显酸性 |
有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是
| A.三种溶液pH的大小顺序是③>②>① |
| B.若将三种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是① |
| D.若三种溶液的pH均为9,则物质的量浓度的大小顺序③>①>② |
已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
| A.所得溶液中的c(H+)=1.0×10-13mol·L-1 |
| B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1 |
| C.所加的烧碱溶液pH=13 |
| D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1 |
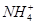 )+c(Fe2+)+c(H+)=c(OH-)+c(
)+c(Fe2+)+c(H+)=c(OH-)+c(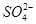 )
) )=c(
)=c(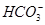 )+3c(H2CO3)+2c(H+)
)+3c(H2CO3)+2c(H+)