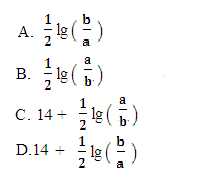题目内容
在蒸发皿中加热蒸干再加热(低于400℃)下列物质的溶液,可以得到该物质固体的是( )
| A.氯化铝 | B.碳酸氢钠 | C.硫酸亚铁 | D.硫酸镁 |
D
解析试题分析:A.氯化铝是强酸弱碱盐。加热促进盐水解产生氢氧化铝和盐酸。盐酸有挥发性,会随着水分的蒸发而挥发,所以蒸干得到的固体为氢氧化铝。再加热氢氧化铝分解得到氧化铝。错误。B.碳酸氢钠溶液蒸干得到NaHCO3.再加热发生分解反应2NaHCO3 Na2CO3+CO2↑+H2O。因此最后得到的固体为Na2CO3。错误。C.硫酸亚铁是强碱弱酸盐。加热促进盐水解产生氢氧化铝和硫酸。由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸亚铁。但是由于在加热的过程中有空气中的氧气参加反应,因此硫酸亚铁会被氧化为硫酸铁。所以固体为硫酸铁。错误。D.硫酸镁硫酸亚铁是强碱弱酸盐。加热促进盐水解产生氢氧化铝和硫酸。由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸镁,最后的固体为硫酸镁。正确。
Na2CO3+CO2↑+H2O。因此最后得到的固体为Na2CO3。错误。C.硫酸亚铁是强碱弱酸盐。加热促进盐水解产生氢氧化铝和硫酸。由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸亚铁。但是由于在加热的过程中有空气中的氧气参加反应,因此硫酸亚铁会被氧化为硫酸铁。所以固体为硫酸铁。错误。D.硫酸镁硫酸亚铁是强碱弱酸盐。加热促进盐水解产生氢氧化铝和硫酸。由于硫酸没有挥发性,所以水分挥发,二者会重新反应得到硫酸镁,最后的固体为硫酸镁。正确。
考点:考查盐水解在溶液加热蒸干得到的固体中的应用的知识。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案常温下,在10 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是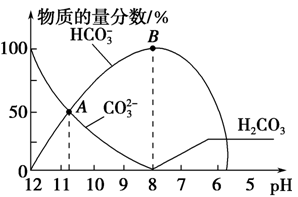
| A.在0.1 mol·L-1 Na2CO3溶液中:c(Na+)+ c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| B.当溶液的pH为7时,溶液的总体积为20 ml |
| C.在B点所示的溶液中,浓度最大的阳离子是Na+ |
| D.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) |
下列说法不正确的是
| A.NaHCO3和Na2CO3混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.常温下,浓度均为0.1 mol·L-1下列各溶液的pH:NaOH>Na2CO3> NaHCO3> NH4Cl |
| C.向冰醋酸中逐滴加水,醋酸的电离程度、pH均先增大后减小 |
| D.常温下,pH=1的稀硫酸与醋酸溶液中,c(SO42-)与c(CH3COO-)之比为2∶1 |
下列表达不正确的是
A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS-  H++S2- H++S2- |
| B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl) |
| C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-) |
| D.同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
25 ℃时,a mol·L一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
| A.a=b | B.a>b |
| C.c(A-)=c(Na+) | D.c(A-)<c(Na+) |
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.与AlCl3溶液反应发生的离子方程式为Al3++3OH—=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH—)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中粒子的数目减小 |
| B.再加入CH3COONa固体能促进醋酸的电离 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
D.溶液中 不变 不变 |
已知H2CO3的酸性强于H2S,将a mol·L-1NaHS与b mol·L-1NaOH两种稀溶液等体积混合(a>0,b>0),所得溶液中微粒间的物质的量浓度关系正确的是
| A.a=b时:c(OH-)=c(H+)+c(HS-) |
| B.a=2b时:c(S2-)>c(HS-)>c(OH-)>c(H+) |
| C.a=3b时:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D.a=4b时:4c(Na+)=5c(S2-)+5c(HS-)+5c(H2S) |
 M2+(aq)+2OH-(aq),Ksp =a,c(M2+)=bmol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq),Ksp =a,c(M2+)=bmol·L-1时,溶液的pH等于