题目内容
【题目】用含FeCl2杂质的氯化铜晶体制纯净CuCl2·2H2O的过程是:先将晶体配制成水溶液,然后按如下图步骤进行提纯:
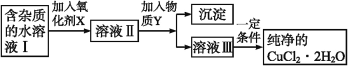
已知:在上述流程条件下,Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______。得到溶液II,最适合作氧化剂X的是______(选填以下编号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)为了除去Fe3+,需加入物质Y调节溶液的pH范围是_________________
(3)溶液Ⅲ得到CuCl2·2H2O晶体的操作是:蒸发浓缩,冷却结晶,____,___,干燥。
【答案】将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离 C 3.2~4.7之间 过滤 洗涤
【解析】
(1)根据表中数据,应将Fe2+转化成Fe3+,即氧化剂X的作用是将Fe2+氧化成Fe3+,便于生成Fe(OH)3而与Cu2+分离;加入氧化剂不能引入新杂质,A、加入K2Cr2O7引入K+和Cr3+,故A不符合题意;
B、加入NaClO,引入Na+,故B不符合题意;
C、H2O2为绿色氧化剂,不引入新杂质,故C符合题意;
D、加入KMnO4,引入K+和Mn2+,故D不符合题意;
(2)调节pH,应将Fe3+完全转变成沉淀,Cu2+不能沉淀,因此调节pH的范围是3.2≤pH<4.7;
(3)得到CuCl2·2H2O,采用操作步骤是蒸发浓缩,冷却结晶、过滤、洗涤、干燥。

 名校课堂系列答案
名校课堂系列答案【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D






