题目内容
【题目】有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,C及其合金是人类最早使用的金属材料。D与A位于同一主族,是构成地球上矿物质的主要元素。请回答下列问题:
(1)元素A能形成多种单质,其中的一种单质能用作电极、润滑剂与制造铅笔等。A与D所形成的化合物属于 晶体,其中心原子是以 杂化成键;
(2)B的核外电子排布式为 ,
(3)向含有C的硫酸盐中逐滴滴加氨水,所观察到的现象是 ;再向上述溶液中加入乙醇,有 ;原因是 ;
(4)A的氢化物比D的氢化物相比,熔点高是的 (填化学式),理由是
(5)下列说法正确的是( )
a.晶体析出规则是晶格能高的晶体最后析出
b.铜型和钾型都是密置层堆积方式
c.在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子
d.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高
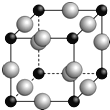
(6)下图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为_____________,已知两个最近的Ca原子之间的距离为apm,则该合金的密度为_____________g/cm3,(用含NA和a的代数式表示)。

【答案】(1)原子晶体;sp3;
(2)[Ar]3d104s24p5或1s22s22p63s23p63d104s24p5
(3)开始有蓝色沉淀生成,随着氨水的滴入,沉淀的量逐渐增加至最多后开始溶解,最后蓝色沉淀完全消失,形成深蓝色的透明溶液;深蓝色晶体析出;[Cu(NH3)4]SO4·H2O易溶于极性溶剂,难溶于极性较小或非极性溶剂;
(4)SiH4;CH4与SiH4是组成与结构相似的物质,而CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低;
(5) c
(6)1:5;![]() 。
。
【解析】试题分析:有A、B、C、D四种元素,A元素的原子的所有能级具有相同的电子数,电子排布为1s22s22p2,为C元素;由B元素形成的单质在常温常压为易挥发的液体,可从海水是提取,为Br元素;C及其合金是人类最早使用的金属材料,为Cu元素;D与A位于同一主族,是构成地球上矿物质的主要元素,为Si元素。
(1)SiC属于原子晶体,晶体中C原子周围的Si原子呈四面体分布, Si原子周围的C原子也呈四面体分布,其中心原子是以sp3杂化成键,故答案为:原子晶体;sp3;
(2)Br元素是35号元素,核外电子排布式为, [Ar]3d104s24p5或1s22s22p63s23p63d104s24p5;
(3)向硫酸铜溶液中逐滴滴加氨水,可以观察到开始有蓝色沉淀生成,随着氨水的滴入,沉淀的量逐渐增加至最多后开始溶解,最后蓝色沉淀完全消失,形成深蓝色的透明溶液;再向上述溶液中加入乙醇,[Cu(NH3)4]SO4·H2O易溶于极性溶剂,难溶于极性较小或非极性溶剂;有深蓝色晶体析出,故答案为:开始有蓝色沉淀生成,随着氨水的滴入,沉淀的量逐渐增加至最多后开始溶解,最后蓝色沉淀完全消失,形成深蓝色的透明溶液;深蓝色晶体析出;[Cu(NH3)4]SO4·H2O易溶于极性溶剂,难溶于极性较小或非极性溶剂;
(4) CH4与SiH4是组成与结构相似的物质,而CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低,故答案为:SiH4;CH4与SiH4是组成与结构相似的物质,而CH4比SiH4的相对分子质量要小,分子间的作用力要小,所以熔点要低;
(5)a.溶解度小的先析出晶体,与晶格能的大小无关,故a错误;b.钾型的空间利用率为68%是非密置层堆积方式,铜型的空间利用率是72%是密置层堆积方式,故b错误;c.采用沿X、Y、Z三轴切割的方法判断二氧化碳分子的个数为12,所以在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子,故c正确;d.能形成分子间氢键的物质沸点较高,邻羟基苯甲醛容易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,所以邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,故d错误;故选c;
(6)晶胞中Ca位于定点,N(Ca)=8×![]() =1,Cu位于面心和体心,共有N(Cu)=8×
=1,Cu位于面心和体心,共有N(Cu)=8×![]() +1=5,则该合金中Ca和Cu的原子个数比为1:5;1mol晶体的质量为40+64×5=360g,1mol晶体含有NA个晶胞,因此该晶体的密度为
+1=5,则该合金中Ca和Cu的原子个数比为1:5;1mol晶体的质量为40+64×5=360g,1mol晶体含有NA个晶胞,因此该晶体的密度为![]() ,故答案为:1:5;
,故答案为:1:5;![]() 。
。