题目内容
6.某同学做同族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中“实验方案”与“实验现象”前后不一定是对应关系).| 实验方案 | 实验现象 |
| ①将氯水滴加到溴化钠溶液中,振荡后加入适量CCl4溶液,振荡,静置 | A.浮在水面,熔成小球,不定向移动,随之消失 |
| ②将一小块金属钠放入冷水中 | B.分层,上层无色,下层紫红色 |
| ③将溴水滴加到NaI溶液中,振荡后加入适量CCl4溶液,振荡,静置 | C.浮在水面,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失 |
| ④将一小块金属钾放入冷水中 | D.分层,上层无色,下层橙红色 |
(1)实验目的:探究同主族元素性质的相似性与递变性
(2)实验用品:
①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol/LNaBr溶液、0.1mol/LNaI溶液、CCl4等.
②仪器:胶头滴管、试管、烧杯、镊子、小刀、玻璃片等.
(3)实验内容(填写与实验方案对应的实验现象的标号及化学方程式和离子方程式)
| 实验方案 | 实验现象 | 化学方程式 | 离子方程式 |
| ① | |||
| ② | |||
| ③ | |||
| ④ |
分析 (1)依据题干信息结合实验过程和现象可知是研究同主族元素性质的递变规律;
(2)根据仪器的作用选取仪器;
(3)依据实验步骤和实验现象,结合物质性质和反应现象进行对应,写出反应的化学方程式;
(4)分析金属和非金属反应的产物和剧烈程度,结合金属性和非金属性强弱的判断依据分析判断,同主族从上到下失电子能力依次增强,得电子能力依次减弱.
解答 解:(1)依据某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,结合实验过程和实验现象可知实验目的是探究同主族元素性质的相似性和递变性,
故答案为:探究同主族元素性质的相似性和递变性;
(2)还需要胶头滴管滴加溶液,故答案为:胶头滴管;
(3)①将氯水滴加到NaBr溶液中,振荡后再加入适量CCl4,振荡,静置,D、分层,上层无色,下层橙红色,反应为Cl2+2NaBr═2NaCl+Br2 ;
②将一小块金属钠放入到冷水中,A、浮在水面上,熔成小球,不定向移动,随之消失,反应的化学方程式为 2Na+2H2O═2NaOH+H2↑;
③将溴水滴加到NaI溶液中,振荡后再加入适量 CCl4,振荡,静置,B、分层,上层无色,下层紫红色,反应为 Br2+2NaI═2NaBr+I2 ;
④将一小块金属钾放入冷水中,C、浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失,反应为2K+2H2O═2KOH+H2↑,
故答案为:
| 实验内容 | 实验现象 | 化学方程式 |
| ① | D | Cl2+2NaBr═2NaCl+Br2 |
| ② | A | 2Na+2H2O═2NaOH+H2↑ |
| ③ | B | Br2+2NaI═2NaBr+I2 |
| ④ | C | 2K+2H2O═2KOH+H2↑ |
故答案为:同主族元素性质相似,自上而下元素金属性增强,非金属性减弱.
点评 本题考查性质实验方案设计,明确同一主族元素原子结构与性质递变规律是解本题关键,会根据实验现象分析总结归纳物质性质,题目难度不大.

练习册系列答案
相关题目
16.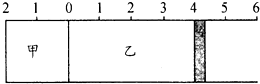 如图所示,甲容器容积不变,乙容器有可移动活塞.甲中充入
如图所示,甲容器容积不变,乙容器有可移动活塞.甲中充入
3mol A和2mol B,乙中充入2mol C和2mol D,发生反应
3A(g)+2B(s)?C(g)+D(g);△H>0.
在相同温度下反应达到平衡,活塞停留在4处.下列有关说法正确的是( )
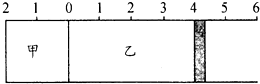 如图所示,甲容器容积不变,乙容器有可移动活塞.甲中充入
如图所示,甲容器容积不变,乙容器有可移动活塞.甲中充入3mol A和2mol B,乙中充入2mol C和2mol D,发生反应
3A(g)+2B(s)?C(g)+D(g);△H>0.
在相同温度下反应达到平衡,活塞停留在4处.下列有关说法正确的是( )
| A. | 平衡后,容器内压强:P甲>P乙 | |
| B. | 平衡后,若向乙中再加入B物质,活塞向右移动 | |
| C. | 平衡后,若将活塞移动至6处,乙中c(A)、c(D)均减小 | |
| D. | 同时升高相同温度,达新平衡时,甲中速率v正(A)等于乙中速率v正(A) |
17.肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气.
已知:N2(g)+2O2(g)═N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
已知:N2(g)+2O2(g)═N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1076.7 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1059.3 kJ/mol |
14.下列各分子中,所有原子都满足最外层为8电子结构的是( )
| A. | H2O | B. | NH3 | C. | Cl2 | D. | H2S |
1.下列关于元素周期表的说法中,错误的是( )
| A. | 元素原子的最外层电子数等于其所在族的序数 | |
| B. | 元素原子的电子层等于其所在周期的序数 | |
| C. | 同一主族元素的原子最外层电子数相同,化学性质相似 | |
| D. | 元素周期表是元素周期律的具体表现形式 |
11.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24L甲苯中含有0.7NA个碳原子 | |
| B. | 7.8gNa2O2固体中含有的离子总数为0.4NA | |
| C. | 64g铜粉与足量的硫粉共热反应,转移的电子总数为2NA | |
| D. | 常温常压下,92g NO2和N2O4的混合气体中含有的原子总数为6NA |
15.关于同温同压下、等体积N2和CO的叙述:①质量相等 ②密度相等 ③所含分子数相等 ④所含电子数相等. 其中正确的是( )
| A. | ①②③④ | B. | ②③④ | C. | ②③ | D. | ③④ |