题目内容
【题目】NH3是一种重要的工业原料。下列关于合成氨的说法中,不正确的是( )
A.工艺涉及催化技术
B.工艺涉及高温高压技术
C.原料之一的氮气来自空气
D.从合成塔出来的气体中,氨的体积分数为100%
【答案】D
【解析】
NH3是一种重要的工业原料,合成氨反应为:N2+3H2![]() 2NH3△H<0。
2NH3△H<0。
A.氮肥厂利用氮气和氢气在有铁存在的情况下合成氨,铁是该反应的催化剂,催化剂可降低反应物的活化能,提高活化分子百分数,活化分子数目增多,提高了反应速率,故A正确;
B.合成氨的过程中,为保障反应速率和限度较大、催化剂的活性大,要选择适宜的温度400~500℃,压强在20~50Mpa之间,故B正确;
C.根据工业生产中,要求经济利益最大化,空气中有大量氮气,氮气来自空气廉价,氢气来自水和碳氢化合物,故C正确;
D.该反应为可逆反应,可逆反应在一定条件下达到化学反应限度时,可逆反应到达平衡状态,正逆反应速率相等,反应物不可能完全转化,故D错误;
故选D。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
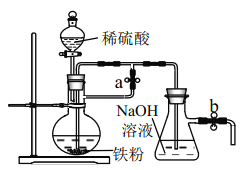
蓝天教育暑假优化学习系列答案【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将![]() 转化为
转化为![]() 如图
如图![]()
(1)Fe3+与Cu粉发生反应的离子方程式为______.
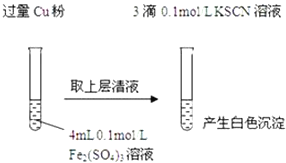
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
![]() 的化学性质与
的化学性质与![]() 相似,
相似,![]() 白色
白色![]()
实验方案 | 现象 | 结论 |
步骤1:取4mL ______ | 产生白色沉淀 |
|
步骤2:取 ______ | 无明显现象 |
![]() 与
与![]() 反应的离子方程式为______.
反应的离子方程式为______.
实验Ⅱ:将![]() 转化为
转化为![]()
实验方案 | 现象 |
向3mL | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:查阅资料:![]() 棕色
棕色![]()
(3)用离子方程式解释NO产生的原因______.
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:![]() 与
与![]() 反应;反应Ⅱ:
反应;反应Ⅱ:![]() 与NO反应
与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ______![]() 填“快”或“慢”
填“快”或“慢”![]() .
.
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______.
【题目】(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器内,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。
CO2(g)+H2(g)。
得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
①实验1中以v(CO2)表示的反应速率为___。
②该反应的逆反应为___(填“吸”或“放”)热反应。
(2)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) △H<0该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到平衡,而在t2、t8时都改变了条件,试从以下措施中选出适宜的改变条件:t2___、t8___。(此处两空均填下列选项字母序号)
a.增加CO的物质的量 b.加催化剂 c.升高温度 d.压缩容器体积 e.将CH3OH气体液化 f.充入氦气
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆应速率与时间的关系曲线___。
(3)已知反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)在100kPa下△H=-113.0kJ/mol,△S=-145.3J·mol-1·K-1。理论上,该反应在温度___(填“高于”或“低于”)___时均可自发进行。
N2(g)+2CO2(g)在100kPa下△H=-113.0kJ/mol,△S=-145.3J·mol-1·K-1。理论上,该反应在温度___(填“高于”或“低于”)___时均可自发进行。