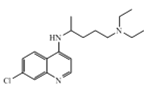
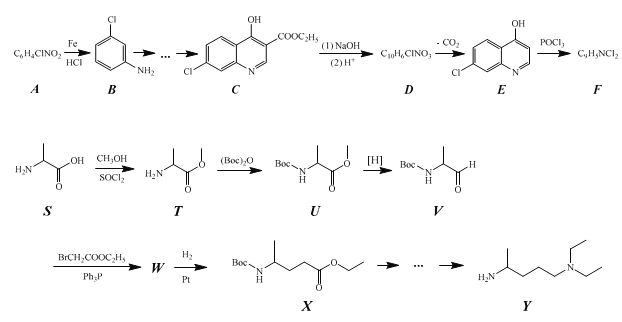
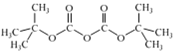
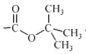
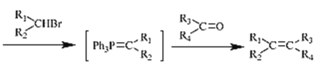题目内容
【题目】对于密闭容器中的反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是
2SO3(g) △H<0,450℃时,n(SO3)和n(O2)随时间的变化关系如图所示,下列说法正确的是

A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d (t1时刻)和点e (t2时刻)处n(SO2)不一样
D.其他条件不变,600℃时反应至t1时刻,n(SO 3)比上图中的e点值要大
【答案】B
【解析】
A.由图象可知,点c处O2和SO3物质的量相等,但是未达到平衡,A错误;
B.b点O2物质的量浓度比a点小,b的正反应速率比点a的小, B正确;
C.点d和点e都处于同一平衡状态下,所以SO2的物质的量相同,C错误;
D.2SO2(g)+O2(g)![]() 2SO3(g) △H<0,450℃升高到600℃,平衡逆向移动,其他条件不变,600℃时反应至t1时刻,n(SO3)比上图中的e点值要小,D错误;
2SO3(g) △H<0,450℃升高到600℃,平衡逆向移动,其他条件不变,600℃时反应至t1时刻,n(SO3)比上图中的e点值要小,D错误;
选B。

【题目】某化学兴趣小组的同学利用酸碱滴定法测定某变质烧碱样品(含Na2CO3杂质)中 NaOH 的质量分数。实验步骤如下:
(I)迅速地称取烧碱样品0.50 g,溶解后配制成100 mL溶液,备用。
(II)将0.1000 mol·L1HCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取 20.00mL 样品溶液于锥形瓶中,滴加 2 滴酚酞;以HCl 标准溶液滴定至第一终点,记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用 HCl 标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如下:
实验序号 | 1 | 2 | 3 |
V0/ mL | 0.00 | 0.00 | 0.00 |
V1/ mL | 22.22 | 22.18 | 22.20 |
V2/ mL | 23.72 | 23.68 | 23.70 |
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和__。酸式滴定管用蒸馏水洗净后、装入标准溶液并调零之前,应进行的操作是__。
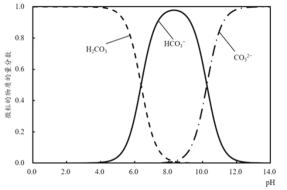
(2)溶液中的H2CO3、![]() 、
、![]() 的物质的量分数随 pH 的变化如图所示:
的物质的量分数随 pH 的变化如图所示:
酚酞和甲基橙指示剂的变色pH范围及对应颜色见表。
酚酞 | 无色 pH < 8.0 | 粉红 pH 8.0~9.8 | 红 pH > 9.8 |
甲基橙 | 红 pH < 3.1 | 橙 pH 3.1~4.4 | 黄 pH > 4.4 |
①滴定至第一终点时,溶液中含碳微粒的主要存在形式为__。
②滴定至第一终点的过程中,发生反应的离子方程式为__。
③已知:pKa1= lgKa1,结合图像可知,H2CO3的pKa1约为__。
a.5.0 b.6.4 c.8.0 d.10.3
(3)下列有关滴定的说法正确的是__。
a.滴定至第一终点时,溶液中 c(H+)+c(Na+) = 2c(![]() ) + c(
) + c(![]() ) + c(OH)
) + c(OH)
b.滴定至第一终点时,溶液中 n(Cl) +n(![]() ) + n(
) + n(![]() ) + n(H2CO3) =n(Na+)
) + n(H2CO3) =n(Na+)
c.判断滴定至第二终点的现象是溶液由黄色变为橙色
d.记录酸式滴定管读数V1时,俯视标准液液面,会导致测得的NaOH质量分数偏低
(4)样品中NaOH的质量分数![]() (NaOH) =__%(计算结果保留小数点后 1 位)
(NaOH) =__%(计算结果保留小数点后 1 位)