题目内容
(14分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是_____________________________。
(2) 化合物Y2X2的电子式为 ;它含有的化学键类型有 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_____________________________________。
(5) 写出化合物Y2X2与水反应的离子方程式____________________________。
(6) B的最高价氧化物的结构式为____________________________________。
(1)第二周期ⅥA族 (2) 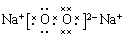 A、C(全对给分)
A、C(全对给分)
(3)H2O2+H2S=S↓+2H2O (4)H2 – 2e- + 2OH-=2H2O
(5)2Na2O2+2H2O=4 Na++4OH-+O2↑ (6) O=C=O
【解析】:常见的10电子化合物中均含有氢原子,因此A是H。化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,很明显是过氧化钠的性质,即X是O,Y是Na。B的原子序数小于A的,且氢化物是10电子,所以该化合物是甲烷或氨气,即B是C或N。因为B与Z的最外层电子数之比为2∶3,所以B不可能是氮元素,只能是碳元素,因此Z的最外层电子数是6,即是S;H和O及H和S形成的18电子的化合物分别水H2O2和H2S,双氧水具有氧化性,硫化氢具有还原性,二者可以发生氧化还原反应生成硫单质;在燃料电池中氢气失去电子,发生氧化反应,因此在负极通入,电极反应式为H2 – 2e- + 2OH-=2H2O;C的最高价氧化物是CO2,其中碳和氧之间形成的碳氧双键,所以结构式为O=C=O。





