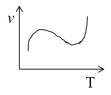
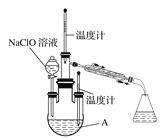
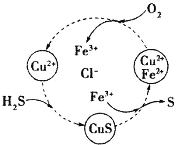
题目内容
【题目】向含溶质amol NaAlO2、amol Na2CO3的混合溶液中加入bmol盐酸,充分反应,下列说法不正确的是( )
A.当a≥b时,![]() +H++H2O=Al(OH)3↓
+H++H2O=Al(OH)3↓
B.当5a=2b时,5H++2![]() +H2O+2
+H2O+2![]() =CO2↑+
=CO2↑+![]() +2Al(OH)3↓
+2Al(OH)3↓
C.当b=4a时,沉淀质量为26ag
D.当b=4.5a时,溶液中Al3+与Al(OH)3物质的量之比为1∶1
【答案】C
【解析】
含溶质amol NaAlO2、amol Na2CO3的混合溶液中加入bmol盐酸,首先发生H++![]() +H2O=Al(OH)3↓,其次发生H++
+H2O=Al(OH)3↓,其次发生H++![]() =
=![]() 、
、![]() +H+=CO2↑+H2O,盐酸过量,再发生Al(OH)3 + 3H+=Al3++ 3H2O,据此分析解答。
+H+=CO2↑+H2O,盐酸过量,再发生Al(OH)3 + 3H+=Al3++ 3H2O,据此分析解答。
A.根据H++![]() +H2O=Al(OH)3↓,当a≥b时,盐酸只与NaAlO2反应,故A正确;
+H2O=Al(OH)3↓,当a≥b时,盐酸只与NaAlO2反应,故A正确;
B.当5a=2b时,即加入2.5amol盐酸,首先发生H++![]() +H2O=Al(OH)3↓,其次发生H++
+H2O=Al(OH)3↓,其次发生H++![]() =
=![]() 、
、![]() +H+=CO2↑+H2O,则生成amolAl(OH)3,0.5amolCO2、0.5amol
+H+=CO2↑+H2O,则生成amolAl(OH)3,0.5amolCO2、0.5amol![]() ,反应的离子方程式为5H++2
,反应的离子方程式为5H++2![]() +H2O+2
+H2O+2![]() =CO2↑+
=CO2↑+![]() +2Al(OH)3↓,故B正确;
+2Al(OH)3↓,故B正确;
C.当b=4a时,首先发生H++![]() +H2O=Al(OH)3↓,其次发生H++
+H2O=Al(OH)3↓,其次发生H++![]() =
=![]() 、
、![]() +H+=CO2↑+H2O,剩余amolHCl与amolAl(OH)3反应,沉淀质量为
+H+=CO2↑+H2O,剩余amolHCl与amolAl(OH)3反应,沉淀质量为![]() mol×78g/mol=52ag,故C错误;
mol×78g/mol=52ag,故C错误;
D.当b=4.5a时,由C分析可知应有1.5amolHCl与amolAl(OH)3反应,反应后溶液中Al3+与Al(OH)3物质的量之比为1∶1,故D正确;
故选C。

【题目】请同学们仔细阅读下表,并回答下列问题:
元素 | 甲 | 乙 | 丙 |
元素符号 | ① | Cl | O |
原子结构示意图 |
| ② | ③ |
周期 | 三 | ④ | 二 |
族 | ⑤ | ⅦA | ⅥA |
(1)写出①的元素符号___,②的原子结构示意图___,④的周期___,⑤的族___;
(2)甲元素最高价氧化物对应的水化物呈___性(填“酸”或“碱”),乙元素最高价氧化物对应的水化物的化学式为___,甲元素最高价氧化物对应的水化物与乙元素最高价氧化物对应的水化物相互反应的化学方程式为___;
(3)甲与乙两元素的单质反应生成物的电子式为___。