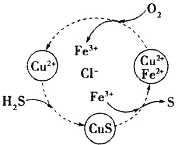
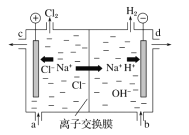
题目内容
【题目】下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:

(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑦元素位于周期表的__________区。
(2)②、⑥两元素形成的化合物的空间构型为__________,其中心原子的杂化轨道类型为__________。
(3)写出元素⑧基态原子的电子排布式_______________________。
(4)③④⑤⑥四种元素第一电离能的由小到大的顺序为______________(填元素符号)。
(5)与③⑤形成的三原子化合物互为等电子体的分子为__________________。
(6)元素⑧与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于__________晶体(填晶体类型)。
【答案】p 平面正三角形 sp2杂化 ![]() 或
或![]()
![]() CS2或N2O 分子晶体
CS2或N2O 分子晶体
【解析】
由元素在周期表中位置,可知①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为He、⑧为Fe元素。
(1)⑦为He,核外电子排布为1s2;
(2)②、⑥两元素形成的化合物为BF3,计算B原子孤电子对数、价层电子对数,确定空间构型与B原子杂化方式;
(3)元素⑧为Fe,核外电子数为26,根据核外电子排布规律书写基态原子的电子排布式;
(4)一般情况下同一周期的元素,原子序数越大,元素的第一电离能越大。N元素原子2p能级为半满稳定结构,能量较低,第一电离能高于同周期相邻元素;
(5)等电子体是原子个数相同,原子最外层电子数也相同的元素,结合③⑤形成的三原子化合物CO2的分子结构判断;
(6)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体。
由元素在周期表中位置,可知①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为He、⑧为Fe元素。
(1)⑦为He,核外电子排布为1s2,处于周期表中p区;
(2)②、⑥两元素形成的化合物为BF3,B原子孤电子对数为0、价层电子对数3,空间构型为平面正三角形,B原子杂化方式为sp2杂化;
(3)元素⑧为Fe,核外电子数为26,根据核外电子排布规律可得基态原子的电子排布式1s22s22p63s23p63d64s2;
(4)一般情况下同一周期的元素,原子序数越大,元素的第一电离能越大。N元素原子2p能级为半满稳定结构,能量较低,第一电离能高于同周期相邻元素,故③④⑤⑥四种元素第一电离能的由小到大的顺序为C<O<N<F;
(5)③⑤形成的三原子化合物是CO2,最外层电子数是16,由于等电子体是原子个数相同,所以其等电子体可能为CS2或N2O等;
(6)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体。

 期末冲刺100分创新金卷完全试卷系列答案
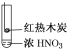
期末冲刺100分创新金卷完全试卷系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应