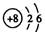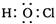题目内容
(12分)下表是短周期中部分元素的原子半径及主要化合价。
请回答:
(1)Z在元素周期表中的位置是 ,Z单质与Y的最高价氧化物对应水化物的浓溶液反应可生成一种红棕色气体,则反应的化学方程式为 。
(2)实验室制取YW3的化学方程式为 。
(3)R2X2与W2X反应的离子方程式为 ,若反应中转移的电子数为0.4×6.02×1023,则参加反应的R2X2的质量为 。
(4)X与Z组成一种有臭味的气体,与氧气按物质的量之比为1:2混合后恰好完全燃烧,生成稳定的氧化物,在同温同压下测得燃烧前后气体的总体积不变,则该反应的化学方程式是 。
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
(1)Z在元素周期表中的位置是 ,Z单质与Y的最高价氧化物对应水化物的浓溶液反应可生成一种红棕色气体,则反应的化学方程式为 。
(2)实验室制取YW3的化学方程式为 。
(3)R2X2与W2X反应的离子方程式为 ,若反应中转移的电子数为0.4×6.02×1023,则参加反应的R2X2的质量为 。
(4)X与Z组成一种有臭味的气体,与氧气按物质的量之比为1:2混合后恰好完全燃烧,生成稳定的氧化物,在同温同压下测得燃烧前后气体的总体积不变,则该反应的化学方程式是 。
1)第二周期、IVA族 (2分)
C+4HNO3(浓) CO2↑+4NO2↑+2H2O (2分)
CO2↑+4NO2↑+2H2O (2分)
(2)Ca(OH)2+2NH4Cl="===" CaCl2+2NH3↑+2H2O (2分)
(3)2Na2O2+2H2O=4Na+ + 4OH- +O2↑ (2分)
31.2 g (2分)
(4)C3O2+2O2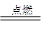 3CO2 (2分)
3CO2 (2分)
C+4HNO3(浓)
 CO2↑+4NO2↑+2H2O (2分)
CO2↑+4NO2↑+2H2O (2分)(2)Ca(OH)2+2NH4Cl="===" CaCl2+2NH3↑+2H2O (2分)
(3)2Na2O2+2H2O=4Na+ + 4OH- +O2↑ (2分)
31.2 g (2分)
(4)C3O2+2O2
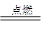 3CO2 (2分)
3CO2 (2分)各元素均为短周期元素,由元素周期律可知,W、R均为第IA族元素,而X、Y、Z半径数值依次增大且非常接近,结合化合价可知,分别为第二周期第VIA、VA、IVA族元素:O、N、C;进一步可知,原子半径最大的R为第三周期的Na,而半径最小的W为第一周期的H。
(1)碳元素位于第二周期、IVA族;
Y的最高价氧化物对应水化物为硝酸,碳单质与浓硝酸发生氧化还原反应,生成红棕色的NO2气体:C+4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)实验室由Ca(OH)2与NH4Cl加热制取氨气:Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(3)Na2O2与H2O生成强碱NaOH及O2,而氧化物不能拆为离子形式,故其离子方程式为:2Na2O2+2H2O=4Na+ + 4OH- +O2↑。
1molNa2O2参加反应有1mol电子的转移,故转移的电子数为0.4×6.02×1023,即0.4mol时,参加反应的Na2O2的质量为0.4×78="31.2" g
(4)依阿伏加德罗定律知,该气体与氧气反应的方程式为:1CmOn+2O2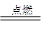 3CO2,再由质量守恒定律可知,该物质化学式为C3O2。故该反应的化学方程式是C3O2+2O2
3CO2,再由质量守恒定律可知,该物质化学式为C3O2。故该反应的化学方程式是C3O2+2O2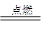 3CO2
3CO2
(1)碳元素位于第二周期、IVA族;
Y的最高价氧化物对应水化物为硝酸,碳单质与浓硝酸发生氧化还原反应,生成红棕色的NO2气体:C+4HNO3(浓)
 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O(2)实验室由Ca(OH)2与NH4Cl加热制取氨气:Ca(OH)2+2NH4Cl
 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O(3)Na2O2与H2O生成强碱NaOH及O2,而氧化物不能拆为离子形式,故其离子方程式为:2Na2O2+2H2O=4Na+ + 4OH- +O2↑。
1molNa2O2参加反应有1mol电子的转移,故转移的电子数为0.4×6.02×1023,即0.4mol时,参加反应的Na2O2的质量为0.4×78="31.2" g
(4)依阿伏加德罗定律知,该气体与氧气反应的方程式为:1CmOn+2O2
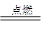 3CO2,再由质量守恒定律可知,该物质化学式为C3O2。故该反应的化学方程式是C3O2+2O2
3CO2,再由质量守恒定律可知,该物质化学式为C3O2。故该反应的化学方程式是C3O2+2O2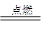 3CO2
3CO2
练习册系列答案
相关题目
 He。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列关于
He。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列关于 ,能用表示核外电子排布的常见阳离子共有( )
,能用表示核外电子排布的常见阳离子共有( )
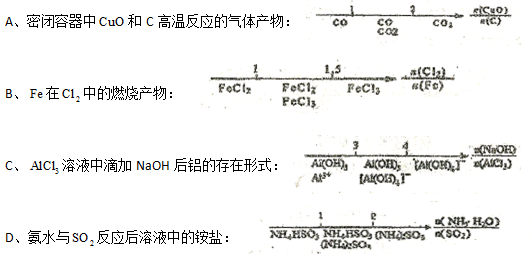
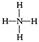
 量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达错误的是
量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达错误的是