题目内容
【题目】某1L待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
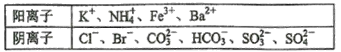
现进行如下实验操作(每次实验所加试剂均过量)
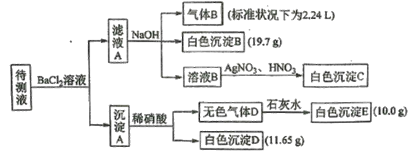
下列说法不正确的是
A.向溶液B中加AgNO3与HNO3的操作是多余的,待测液中一定含有的离子是K+、NH4+、CO32-、HCO3-、且c(K+)≥0.1mol·L-1
B.生成白色沉淀B的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O
C.已知白色沉淀C能溶于浓氨水,离子方程式为AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O
D.若无色气体D是混合气体,则沉淀A的成分可能是BaCO3、BaSO3、BaSO4
【答案】A
【解析】
待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+,滤液A中有Ba2+,加入过量的NaOH溶液得到气体B,白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为0.1molBaCO3,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-,据此分析。
A、向溶液B中加AgNO3与HNO3的操作不是多余的,是为了判断是否含有溴离子,根据上述分析,待测液除含有Na+外,一定含有K+、NH4+、CO32-、HCO3-,n(NH4+)=n(NH3)=0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积正电荷=1×0.1+1×0.2=0.3,单位体积内负电荷=1×0.1+2×0.1+2×0.05=0.4,则c(K+)≥0.1mol·L-1,故A错误;
B、生成白色沉淀B的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O,故B正确;
C、白色沉淀C为AgCl,所以与氨水的离子方程式为AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O,故C正确;
D、若无色气体D是混合气体,由分析可知,则沉淀A的成分可能是BaCO3、BaSO3、BaSO4,故D正确;
故选A。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
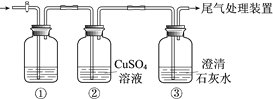
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱