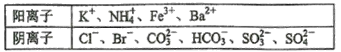题目内容
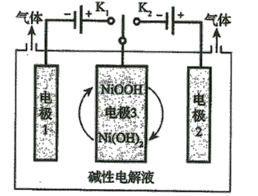
【题目】高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
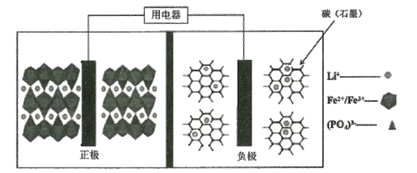
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是
A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn
D.充电时,当导线中传递l mol电子,理论上将有1 mol Li+向左移动
【答案】D
【解析】
该电池的总反应式是:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC,在正极上得电子,其正极反应为:xFePO4+xLi++xe-=xLiFePO4,负极反应为:LixCn- xe-=nC+ xLi+,充电时的两极反应和放电时正好相反,据此回答。
LiFePO4+nC,在正极上得电子,其正极反应为:xFePO4+xLi++xe-=xLiFePO4,负极反应为:LixCn- xe-=nC+ xLi+,充电时的两极反应和放电时正好相反,据此回答。
A、由分析可知,放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4,故A正确;
B、放电时时,电子由负极经导线、用电器、导线到正极,故B正确;
C、充电时,阴极的反应与负极相反,所以阴极电极反应式为:xLi++xe-+nC=LixCn,故C正确;
D、充电时,阳离子向阴极移动,即向右移动,故D错误;
故选D。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】下列有关实验操作、现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向BaCl2溶液中通入CO2 | 产生白色沉淀 | 白色沉淀为BaCO3 |
B | 向 NaHCO3溶液中先加入CaCl2溶液,再加入NaOH溶液 | 产生白色沉淀 | 白色沉淀为CaCO3 |
C | 向某溶液加入NaOH溶液,用湿润的红色石蕊试纸检验产生的气体 | 湿润的红色石蕊试纸未变蓝 | 该溶液中一定不含有 |
D | 向某溶液中先加入HNO3溶液,再加入BaCl2溶液 | 产生白色沉淀 | 该溶液中一定含有 |
A. A B. B C. C D. D
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是元素周期表的一部分。
H | He | ||||||
Li | Be | B | C | N | O | F | Ne |
Na | Mg | Al | Si | P | S | Cl | Ar |
请回答下列问题。
(1)非金属性最强的元素名称为___________,它位于元素周期表中的位置___________。
(2)硅元素的原子结构示意图是____________,其最高价氧化物是____________(填“酸性”或“碱性”)氧化物。
(3)硼酸(H3BO3)的酸性_________(填“>” 或“<”)碳酸(H2CO3)的酸性,说明你判断的理由:__________________________。
(4)NH3的电子式为________________,它属于____________(填“离子”或“共价”)化合物。NH3的还原性_________(填“>” 或“<”)PH3的还原性。
(5)第三周期元素的最高价氧化物对应的水化物中,有一种物质既能与强酸反应又能与强碱反应,写出这种物质跟氢氧化钠溶液反应的化学方程式______________。