题目内容
16.常温常压下,将0.3mol CO2通人盛有23.4g Na2O2的容器中,一段时间后排出气体.所得固体的质量为29.0g,则参加反应的CO2的物质的量与产物Na2CO3 的质量分别为0.2mol、21.2g.分析 发生反应:2Na2O2+2CO2=2Na2CO3+O2 ,根据差量法计算参加反应CO2及产物Na2CO3 的质量,再根据n=$\frac{m}{M}$计算参加反应CO2的物质的量.
解答 解:设参加反应CO2的质量为x,产物Na2CO3 的质量为y,则:
2Na2O2+2CO2=2Na2CO3+O2 固体质量增重
88g 212g 56g
x y 29.0g-23.4g=5.6g
所以x=$\frac{88g×5.6g}{56g}$=8.8g
y=$\frac{212g×5.6g}{56g}$=21.2g
则参加反应CO2的物质的量为$\frac{8.8g}{44g/mol}$=0.2mol,
故答案为:0.2mol、21.2g.
点评 本题考查化学方程式有关计算,注意差量法的应用,侧重考查学生分析计算能力.

练习册系列答案
 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目
6.下列各组盐的混合物加热或溶于水均有CO2气体放出的是( )
| A. | Al2(SO4)3和NaHCO3 | B. | Na2SO4和NH4HCO3 | C. | MgSO4和Na2CO3 | D. | NaHCO3和NaHSO4 |
7.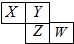 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
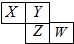 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | 原子半径由大到小排列顺序Z>X>Y | |
| B. | Y元素的两种同素异形体在常温下都是气体 | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
4.NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 常温常压下46g N02和N204混合气体中含有的原子数为3NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA | |
| C. | 常温常压下,1mol有机物C2H60中含有极性键的数目一定为7NA | |
| D. | 一定条件下,2mo1 SO2和1mol 02在混合密闭容器中充分反应后,容器中的分子数大于2NA |
11.下列示意图或图示正确的是( )


| A. | ① | B. | ② | C. | ③ | D. | ④ |
2.下列说法正确的是( )
| A. | 化合物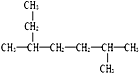 的名称为2-甲基-5-乙基己烷 的名称为2-甲基-5-乙基己烷 | |
| B. | 石油催化裂化的主要目的是提高汽油等轻质油的产量 | |
| C. | 在蛋白质溶液中加入硫酸钠溶液和福尔马林,均能使蛋白质变性,失去生理功能 | |
| D. | CH3COOCH2CH3与CH3CH2CH2COOH互为同分异构体,乙醛和苯甲醛互为同系物 |
3.25℃,两种酸的电离平衡常数如下表.
下列叙述中正确的是( )
| Ka1 | Ka2 | |
| H2A | 1.3×10-2 | 6.3×10-4 |
| H2B | 4.2×10-7 | 5.6×10-11 |
| A. | H2A的电离方程式:H2A?2H++A2- | |
| B. | 常温下,在水中Na2B的水解平衡常数为:Kb1=$\frac{{K}_{w}}{4.2×1{0}^{-7}}$ | |
| C. | 相同pH的Na2A、Na2B溶液中物质的量浓度:c(Na2A)>c(Na2B) | |
| D. | 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2A═A2-+H2B |


 .
.