题目内容
19.已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )| A. | 该溶液的pH=4 | |
| B. | 由HA电离出的c(H+)约为水电离出的c(H+)的106倍 | |
| C. | 在该温度下加水稀释,溶液中$\frac{c({H}^{+})}{c(HA)}$减小 | |
| D. | 此酸的电离平衡常数约为1.0×10-7 |
分析 室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,说明HA部分电离,为弱电解质,
A、根据电离度计算HA溶液中氢离子浓度,从而计算pH;
B、酸溶液中水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
C、加水稀释,弱酸HA的电离平衡正向移动,n(H+)增大,n(HA)减小;
D、此酸的电离平衡常数=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.
解答 解:室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,说明HA部分电离,为弱电解质,
A、c(H+)=0.1mol/L×0.1%=0.0001mol/L,pH=4,故A正确;
B、酸溶液中水电离出的c(H+)等于溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L,由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故B正确;
C、加水稀释,c(H+)和c(HA)都减小,但加水稀释,弱酸HA的电离平衡正向移动,n(H+)增大,n(HA)减小,所以$\frac{c({H}^{+})}{c(HA)}$增大,故C错误;
D、此酸的电离平衡常数=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故D正确;
故选C.
点评 本题考查了弱电解质的电离,根据弱电解质的电离特点、pH的计算方法、电离平衡常数的计算等知识点来分析解答,注意酸中水电离出氢离子的计算方法,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列有关0.1mol•L-1Na2CO3溶液的说法中错误的是( )
| A. | 其中钠离子的浓度为0.2mol•L-1 | |
| B. | 溶液中的OH-浓度大于H+浓度,HCO3-的浓度小于CO32-的浓度 | |
| C. | 溶液中Na+的浓度等于CO32-浓度的二倍 | |
| D. | 溶液中H2CO3分子的浓度为0 |
7.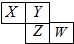 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
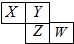 如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的$\frac{7}{10}$,则下列说法中不正确的是( )| A. | 原子半径由大到小排列顺序Z>X>Y | |
| B. | Y元素的两种同素异形体在常温下都是气体 | |
| C. | 最高价氧化物对应水化物的酸性W>Z | |
| D. | 阴离子半径由大到小排列顺序X>Y>Z>W |
4.NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 常温常压下46g N02和N204混合气体中含有的原子数为3NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA | |
| C. | 常温常压下,1mol有机物C2H60中含有极性键的数目一定为7NA | |
| D. | 一定条件下,2mo1 SO2和1mol 02在混合密闭容器中充分反应后,容器中的分子数大于2NA |
11.下列示意图或图示正确的是( )


| A. | ① | B. | ② | C. | ③ | D. | ④ |
6.下列操作后得到的溶液中溶质或离子物质的量浓度肯定为0.1mol•L-1的是( )
| A. | c(K+)为0.05mol•L-1的明矾溶液中的c(SO42-) | |
| B. | 将0.1molNaCl溶解在1L水中形成的溶液中的溶质 | |
| C. | 含0.1NA个阴离子的Na2O2溶于适量的水后形成了1L溶液中的溶质 | |
| D. | 将含0.1molNa2CO3的50g溶液与950g水混合后溶液中的溶质 |

 .
.

 .
.