题目内容
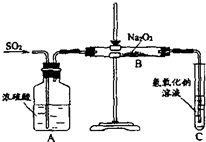
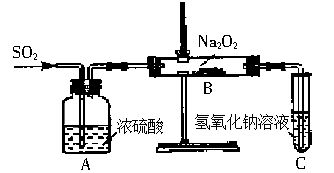
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带火星的木条插入试管C中,木条复燃。
请完成下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是__________________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。____________。
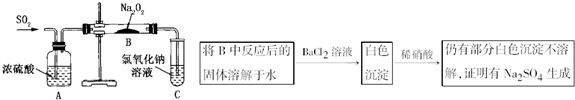
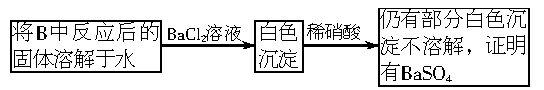
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
![]()
上述方案是否合理?________。请简要说明两点理由:①_____________;②___________。
(1)2Na2O2+2SO2![]() 2Na2SO3+O2
2Na2SO3+O2
(2)取白色固体,加稀硫酸,产生能使品红溶液褪色的气体
(3)不合理
①稀硝酸能将亚硫酸钡氧化为硫酸钡
②如果反应后的固体中还残留Na2O2,它溶于水后能将![]() 氧化成为
氧化成为![]()
解析:若Na2O2与SO2发生反应:2Na2O2+2SO2![]() 2Na2SO3+O2,则其生成物Na2SO3可与酸(盐酸或H2SO4)作用产生能使品红溶液褪色的SO2气体,故取白色固体,加入稀H2SO4,若产生使品红溶液褪色的气体,则白色固体中含Na2SO3。(3)由于稀HNO3具有强氧化性可将BaSO3氧化为BaSO4,或反应后的固体仍有残留强氧化剂Na2O2时,溶于水后,它能将
2Na2SO3+O2,则其生成物Na2SO3可与酸(盐酸或H2SO4)作用产生能使品红溶液褪色的SO2气体,故取白色固体,加入稀H2SO4,若产生使品红溶液褪色的气体,则白色固体中含Na2SO3。(3)由于稀HNO3具有强氧化性可将BaSO3氧化为BaSO4,或反应后的固体仍有残留强氧化剂Na2O2时,溶于水后,它能将![]() 氧化为
氧化为![]() ,故所给方案不合理。
,故所给方案不合理。

练习册系列答案
相关题目


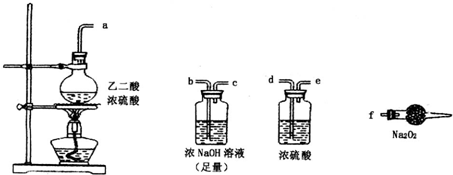
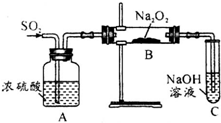 有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
有两个实验小组的同学探究一氧化碳、二氧化硫与过氧化钠的反应.请回答下列问题:
 0
0