题目内容
将N2和 H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体中N2和 H2的体积比;
(2)达到平衡时混合气体中的氨的体积分数;
(3)平衡时N2的转化率。
(1)反应前混合气体中N2和 H2的体积比;
(2)达到平衡时混合气体中的氨的体积分数;
(3)平衡时N2的转化率。
(1)1:4(2分)(2)31.6%(3分)(3)60%(3分)
试题分析:(1)N2和H2按一定比例混合,在相同状况下其密度是H2的3.6倍,则混合气体的平均相对分子质量=3.6×2=7.2,令0.5mol混合气体中N2和H2的物质的量分别为xmol、ymol,则:
x+y=0.5
28x+2y=7.2(x+y)
解得x=0.1,y=0.4,体积之比等于物质的量之比,故反应前混合气体中N2和H2的体积比=0.1:0.4=1:4;
(2)根据压强之比等于物质的量之比,故反应后容器内混合气体总的物质的量=0.5mol×0.76=0.38mol,则:
N2 + 3H2 = 2NH3
平衡时(mol) 0.1-a 0.4-3a 2a
则0.1-a + 0.4-3a + 2a ="0.38" ,解得a=0.06mol,n(NH3)=2a=0.12mol
故NH3 的体积分数=n(NH3)/n总×100%=0.12mol/0.38mol×100%=31.6%;
(3)氮气的转化率="a/" n(起始N2)×100%=0.06mol/0.1mol×100%=60%

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。 C(g) △H=" -a" kJ·mol-1,反应达到平衡状态时生成1 mol C气体,放出热量Q1kJ;乙中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是( )
C(g) △H=" -a" kJ·mol-1,反应达到平衡状态时生成1 mol C气体,放出热量Q1kJ;乙中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是( ) zC(g),平衡时,测得A的浓度为0.50 mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30 mol/L,有关叙述不正确的是( )
zC(g),平衡时,测得A的浓度为0.50 mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30 mol/L,有关叙述不正确的是( ) 2NH3已达到平衡,下列有关说法正确的 ( )
2NH3已达到平衡,下列有关说法正确的 ( ) CO2(g)+ H2(g) 达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为
CO2(g)+ H2(g) 达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为 2CrO42-(黄色)+2H+,
2CrO42-(黄色)+2H+, pC(g)+qD(g);△H<0.下列结论中不正确的是
pC(g)+qD(g);△H<0.下列结论中不正确的是 2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g) ΔH<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是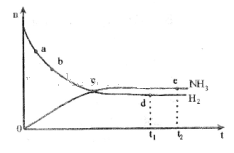
 时刻)和点e(
时刻)和点e( 时刻)处n(
时刻)处n(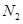 )不一样
)不一样