题目内容
已知重铬酸钾(K2Cr2O7)是一种主要的的无机试剂。
(1)强氧化性的K2Cr2O7溶液中,存在如下平衡: Cr2O72-(橙色)+H2O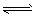 2CrO42-(黄色)+2H+,
2CrO42-(黄色)+2H+,
①若要使溶液的橙色加深,下列可采用的方法是 。
(2)向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,此时溶液中c(Pb2+)/ c(Ba2+)= [结果保留一位小数;已知Ksp(BaCrO4)=1.2×10-10;Ksp(PbCrO4)=2.8×10-13]。
(1)强氧化性的K2Cr2O7溶液中,存在如下平衡: Cr2O72-(橙色)+H2O
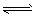 2CrO42-(黄色)+2H+,
2CrO42-(黄色)+2H+,①若要使溶液的橙色加深,下列可采用的方法是 。
| A.加入适量稀盐酸 | B.加入适量稀硫酸 | C.加入适量烧碱固体 | D.加水稀释。 |
(1) B (2分)(2) 2.3×10-3 (2分)
试题分析:A.加入适量稀盐酸,Cr2O72-离子氧化氯离子而使平衡向逆反应方向移动,但Cr2O72-浓度减小,所以溶液橙色变浅,故A错误;B.加入适量稀硝酸,硝酸根离子和Cr2O72-不反应,氢离子浓度增大,平衡向逆反应方向移动,溶液橙色加深,故B正确;C.加入适量烧碱固体,烧碱和氢离子反应使平衡向正反应方向移动,橙色变浅,故C错误;D.加水稀释溶液,促进Cr2O72-水解,所以平衡向正反应方向移动,橙色变浅,故D错误;故选B.2O72-能氧化氯离子,为易错点。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( ) 2SO3(g)ΔH=-196.6 kJ·mol-1)。
2SO3(g)ΔH=-196.6 kJ·mol-1)。 2HI(g),在一恒定压强的容器中进行,下列可以判断此反应达到平衡状态的是( )
2HI(g),在一恒定压强的容器中进行,下列可以判断此反应达到平衡状态的是( ) H2(g)+CO2(g)
H2(g)+CO2(g) 2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是
2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是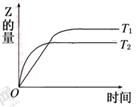
 bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则