题目内容
某兴趣小组为探究外界条件对可逆反应A(g)+B(g) C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
针对上述系列实验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现
 C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。针对上述系列实验,下列结论中错误的是( )
| | A | B | C |
| Ⅰ | 0.050mol·L-1 | 0.050mol·L-1 | 0.050mol·L-1 |
| Ⅱ | 0.070mol·L-1 | 0.070mol·L-1 | 0.098mol·L-1 |
| Ⅲ | 0.060mol·L-1 | 0.060mol·L-1 | 0.040mol·L-1 |
| Ⅳ | 0.080mol·L-1 | 0.080mol·L-1 | 0.12mol·L-1 |
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现
D
试题分析:A、把平衡时各物质的浓度代入平衡常数表达式进行计算得:KⅠ =
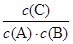 =
= 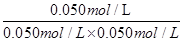 = 20mol-1·L,正确;B、计算平衡常数:KⅡ =
= 20mol-1·L,正确;B、计算平衡常数:KⅡ = 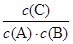 =
= 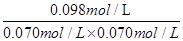 = 20mol-1·L = KⅠ,说明Ⅰ与Ⅱ是相同温度下的平衡状态,则可通过增大浓度或压缩容器体积的方法实验由状态Ⅰ到状态Ⅱ的转化,正确;C、升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,正确;D、计算平衡常数:KⅣ =
= 20mol-1·L = KⅠ,说明Ⅰ与Ⅱ是相同温度下的平衡状态,则可通过增大浓度或压缩容器体积的方法实验由状态Ⅰ到状态Ⅱ的转化,正确;C、升高温度,C的浓度减小,而A、B浓度增大,说明平衡向逆反应方向移动,根据平衡移动原理,升高温度使平衡向吸热反应方向移动,所以逆反应为吸热反应,则正反应为放热反应,正确;D、计算平衡常数:KⅣ = 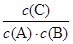 =
= 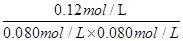 = 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化;错误。
= 18.75mol-1·L≠KⅠ,说明Ⅳ和Ⅰ是不同温度下的平衡状态,只通过压缩容器的体积不能实现由平衡状态Ⅰ到平衡状态的Ⅳ转化;错误。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
 2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是
2SO3(g) ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是 N2O4,下列状态一定是平衡状态的是
N2O4,下列状态一定是平衡状态的是 2c(g);ΔH1<0
2c(g);ΔH1<0 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )