题目内容
【题目】某实验小组用下列装置进行乙醇催化氧化的实验.
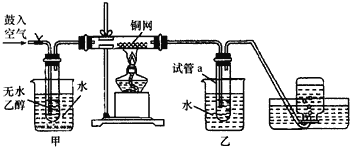
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式____________________;
(2)甲和乙两个水浴作用不相同,甲的作用是________________,乙的作用是_________________;
(3)下列反应原理可以用于检查司机是否酒后开车:
2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(橙色) (绿色)
①若司机酒后开车,应显示出______色;
②生成1mol Cr3+转移的电子数为___________。
【答案】 2Cu+O2 ![]() 2CuO、CH3CH2OH+CuO
2CuO、CH3CH2OH+CuO ![]() CH3CHO+Cu+H2O 加热,使乙醇挥发 冷却,收集乙醛 绿 1.806×1024或3NA
CH3CHO+Cu+H2O 加热,使乙醇挥发 冷却,收集乙醛 绿 1.806×1024或3NA
【解析】试题分析:本题考查乙醇催化氧化的实验,乙醇与强氧化剂的反应。
(1)实验中铜网变黑是Cu与鼓入的空气中的氧气化合成黑色的CuO,反应的化学方程式为:2Cu+O2![]() 2CuO;铜网变红是CuO被乙醇蒸气还原成Cu,反应的化学方程式为:CuO+CH3CH2OH
2CuO;铜网变红是CuO被乙醇蒸气还原成Cu,反应的化学方程式为:CuO+CH3CH2OH![]() Cu+CH3CHO+H2O。
Cu+CH3CHO+H2O。
(2)根据实验装置图知,甲中水浴的作用是:加热,使乙醇挥发。乙中水浴的作用是:冷却收集乙醛。
(3)①若司机酒后开车,呼出的气体中含有CH3CH2OH,能发生题给反应,溶液的颜色由橙色变为绿色,显示出绿色。
②反应中Cr元素的化合价由K2Cr2O7中的+6价降至Cr3+中的+3价,则生成1molCr3+转移3mol电子,转移电子数为3NA或1.806![]() 1024。
1024。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知标况下,5.6LCH4与水蒸气完全反应时吸收51.5KJ的热量,请写出该反应的热化学方程式____;
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____。
②在该温度下,计算该反应的平衡常数K=____。
③下列选项中能表示该反应已达到平衡状态的是____
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是____;
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | span>φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
(4)合成气制甲醚的反应方程式为2CO(g) + 4H2(g)![]() CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。
CH3OCH3(g)+ H2O(g) △H = b kJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、 压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如下图所示。

① 290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是____;
② b____0,(填“>”或“<”或“=”)理由是____。



