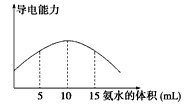
题目内容
【题目】(11分)下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ||||||
(1)①—⑦元素中金属性最强的元素位于周期表第 周期 族。
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。
【答案】⑴3,ⅡA ⑵Si ⑶ ⑷离子键
⑷离子键![]()
⑸⑤⑦②③① ⑹Al(OH)3+3H+=Al3++3H2O
【解析】试题分析:⑴在编号中第⑤号元素镁的金属性最强,其位置是第三周期第IIA族;
⑵在编号中第⑦号元素硅可作为半导体材料;
⑶元素⑥为铝,其原子序数为13,其原子结构示意图为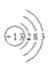 ;
;
⑷元素④为氟元素,元素⑤为镁,二者形成的化合物为MgF2,其含有离子键,其电子式为![]() ;
;
⑸根据元素①、②、③、⑤、⑦在周期表中位置关系确定其原子半径由大到小的顺序是⑤>⑦>②>③>①;
⑹元素③、⑥它们最高价氧化物的水化物分别为HNO3、Al(OH)3,二者发生的化学反应为Al(OH)3+3HNO3=Al(NO3)3+3H2O,然后将其改写为离子方程式即可。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目