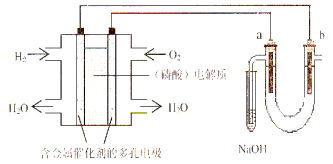
题目内容
【题目】25℃时,0. molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是( )
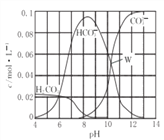
A. W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B. pH=14的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol/L
C. pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)
D. pH=11的溶液中:c(Na+)+ c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
【答案】AC
【解析】A、根据图像可知,W点两曲线相交,c(CO32-)=c(HCO3-),该点时溶液呈碱性,c(OH-)>c(H+),PH大于10,c(OH-)、c(H+)都比较小,故c(CO32-)=c(HCO3-)>c(OH-)>c(H+),A正确;B、pH=14,说明反应中没有CO2生成,所以根据物料守恒可知c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 molL-1,B错误;C、根据图象可知pH=8时,溶液中碳酸氢钠的浓度远远大于碳酸钠的浓度,这说明反应中恰好是生成碳酸氢钠,且碳酸氢钠水解远大于电离,故:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),C正确; D、pH=11时,根据电荷守恒可知:c(Na+)+ c(H+)=c(OH-)+c(Cl-)+2c(CO32-)+c(HCO3-),D错误。答案选AC。

【题目】(11分)下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ||||||
(1)①—⑦元素中金属性最强的元素位于周期表第 周期 族。
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。