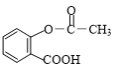
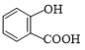
题目内容
【题目】在一定温度下,将气体X和气体Y各![]() 充入10L恒容密闭容器中,发生反应
充入10L恒容密闭容器中,发生反应![]() ,一段时间后达到平衡。反应过程中测定的数据如表:下列说法不正确的是
,一段时间后达到平衡。反应过程中测定的数据如表:下列说法不正确的是
| 2 | 4 | 7 | 9 |
|
|
|
|
|
A.反应前2min的平均速率![]()
B.其他条件不变,升高温度,反应达到新平衡前![]() 正
正![]() 逆
逆![]()
C.该温度下此反应的平衡常数![]()
D.其他条件不变,再充入![]() ,平衡时X的体积分数增大
,平衡时X的体积分数增大
【答案】D
【解析】
A.2min内Y的物质的量变化为![]() ,浓度变化量为
,浓度变化量为![]() ,所以
,所以![]()
![]() ,速率之比等于化学计量数之比,则
,速率之比等于化学计量数之比,则![]()
![]() ,故A正确;
,故A正确;
B. 由于正反应是放热反应,升高温度,平衡向逆反应方向移动,反应达到新平衡前![]() 正
正![]() 逆
逆![]() ,故B正确;
,故B正确;
C. 由表中数据知,7min时,反应达到平衡,平衡时Y的物质的量为![]() ,体积为10L,则
,体积为10L,则
![]()
开始(mol/L) 0.016 0.016 0
转化(mol/L) 0.006 0.006 0.012
平衡(mol/L) 0.01 0.01 0.012
![]() ,故C正确;
,故C正确;
D. 由于该反应是反应前后气体体积不变的反应,再充入![]() ,等效为在原平衡基础上增大压强,平衡不移动,X的体积分数不变,故D错误。
,等效为在原平衡基础上增大压强,平衡不移动,X的体积分数不变,故D错误。
答案选D。

 愉快的寒假南京出版社系列答案
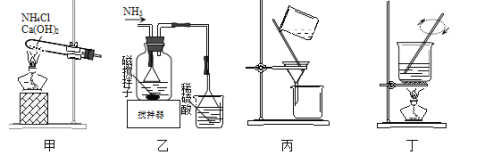
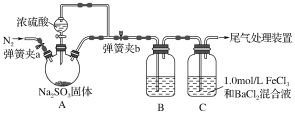
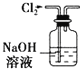
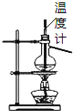
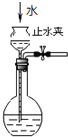
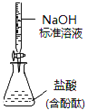
愉快的寒假南京出版社系列答案【题目】碱式氯化镁(MgOHCl)常用作塑料添加剂,工业上制备方法较多,其中利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁的工艺属于我国首创。某中学科研小组根据该原理设计如下装置图进行相关实验,装置C中CuO的质量为8.0g。
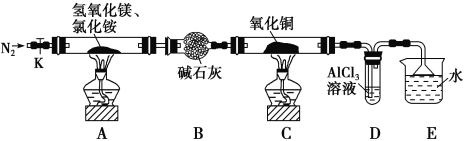
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为:______________。
(2)装置D中生成沉淀,发生反应的离子方程式为___________________。
(3)反应过程中持续通入N2的作用有两点:一是:将装置A中产生的氨气完全导出,二是:_______________________。
(4)反应完毕,装置C中的氧化铜全部由黑色变为红色,称其质量为6.8g,且生成的气体可直接排放到大气中,该反应中转移电子的物质的量为_______mol。
(5)请你设计一个实验方案证明装置C中的氧化铜反应完全后得到的红色固体中含有氧化亚铜。已知:①Cu2O+2H+=Cu2++Cu+H2O
②限选试剂:2 mol·L-1H2SO4溶液、浓硫酸、2 mol·L-1HNO3溶液、10 mol·L-1 HNO3溶液
实验步骤 | 预期现象和结论 |
步骤1:取反应后装置C中的少许固体于试管中 | |
步骤2:______________________________ | _____________________ |
【题目】按要求回答下列问题:
Ⅰ.(1)将NaHSO4溶液滴入到Ba(OH)2溶液中至中性的离子方程式:_______
(2)将5-6滴饱和氯化铁溶液滴入到25mL沸水中,继续加热,得红褐色液体。写出反应的离子方程式:______________
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是____________(用离子方程式表示)。
(4)向Na2S2O3 中加入稀硫酸反应的离子方程式______________。
Ⅱ.金属铬(Cr)的英文是Chromium,原意是颜色,因为它的化合物都有美丽的颜色。如表是几种常见铬的化合物或离子的水溶液的颜色:
离子或化合物 | Cr2O | Cr(OH)3 | Cr3+ | CrO2- | CrO |
颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |
含铬元素的化合物可以发生如图一系列变化:
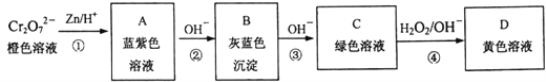
①写出反应④的离子方程式:___________________。
②结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为_______。
Ⅲ.二氧化硫是常见大气污染气体,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2:2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应Na2SO3+CaO+H2O=CaSO3↓+2NaOH
若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的离子方程式____________