题目内容
12.已知锌与稀盐酸反应放热.某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气.所用稀盐酸浓度为1.00mol•L-1、2.00mol•L-1,锌有细颗粒与粗颗粒两种规格,用量为6.50g.实验温度为298K、308K,每次实验稀盐酸的用量为25.0mL.
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响;(Ⅱ)实验①和 ③探究温度对该反应速率的影响;(Ⅲ)实验①和 ④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
②反应速率最大的时间段(即0~10S、10~20S、20~30S、30~40S、40~50S、…)为40~50s,可能原因是反应放热;
③反应速率最小的时间段为90~100s,可能原因是盐酸浓度降低.
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下落溶液以减慢反应速率:
A.蒸馏水B.CuCl2溶液C.NaCl溶液
你认为他上述做法中可行的是AC(填相应字母).
分析 (1)根据实验的目的和影响化学反应速率的因素来设计实验,注意对照实验的设计是关键,采用控制变量法来比较外界条件对反应速率的影响;
(2)①计算氢气的物质的量的变化量△n(H2),根据反应化学方程式,求盐酸的变化量,从计算用盐酸表示的速率;
②根据相等时间段内,产生的氢气的体积越大,可以确定反应速率越快,据影响反应速率的因素来判断;
③根据相等时间段内,产生的氢气的体积越小,可以确定反应速率越慢,据影响反应速率的因素来判断;
(3)根据浓度以及原电池原理的应用来确定化学反应速率的变化情况.
解答 解:(1)(Ⅰ)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,实验①②探究盐酸浓度对该反应速率的影响,所以固体的表面积应该是相同的,实验①是粗颗粒,实验②也是粗颗粒,实验②浓度为1.00mol•L-1;
(Ⅱ)探究温度对该反应速率的影响,则固体的表面积以及盐酸的浓度应该是一样的,所以实验③应该是粗颗粒的固体,盐酸的浓度选择2.00;
(Ⅲ)探究锌规格(粗、细)对该反应速率的影响,要求试验温度以及盐酸的浓度是相等的,实验①盐酸浓度是2.00,所以实验④应该是细颗粒,盐酸浓度是2.00;
故答案为:
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | ③ ④ |
| ② | 298 | 粗颗粒 | 1.00 | |
| ③ | 308 | 粗颗粒 | 2.00 | |
| ④ | 298 | 细颗粒 | 2.00 |
②根据相等时间段内,产生的氢气的体积越大,可以确定反应速率越快,所以反应速率最大的时间段是40~50s,可能原因是反应放热,温度高,反应速率快,故答案为:40~50s;反应放热;
③根据相等时间段内,产生的氢气的体积越小,可以确定反应速率越慢,所以反应速率最大的时间段是90~100s,可能原因是反应进行过程中,盐酸浓度减小,反应速率慢,故答案为:90~100s;盐酸浓度降低;
(3)在硫酸中加入A.蒸馏水、C.NaCl溶液都相当于将硫酸稀释,盐酸中氢离子浓度减小,所以速率减慢,在反应中加入氯化铜,则金属锌会置换出金属铜,形成Cu、Zn、硫酸原电池,会加快反应速率,故选AC.
点评 本题考查化学反应速率的影响因素及反应速率的计算,注意信息中提高的条件及图象的分析是解答的关键,较好的考查学生综合应用知识的能力.

练习册系列答案
相关题目
2.反应4A(g)+5B(g)?4C(g)+6D(g)△H<0,在一定温度下达到化学平衡状态时,下列说法正确的是( )
| A. | 2 v(C)正=3v(D)逆 | |
| B. | 若升高温度最终能生成更多的C和D | |
| C. | 单位时间里有4n mol A消耗,同时有5n mol B生成 | |
| D. | 容器里A、B、C、D的浓度比一定是4:5:4:6 |
3.在学习了物质及其变化之后,某学习小组认为化学反应反应中的先后顺序很重要.他们归纳了下面一些情况,你认为正确的是( )
| A. | 向浓度为0.1 mol/L 的FeI2溶液中通入Cl2,Fe2+先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向等浓度的FeCl3溶液加入质量相等且颗粒大小相同的铁和铜,铜先反应 |
20.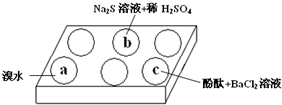 在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
(1)a中实验现象是溴水褪色,该现象可证明Na2SO3具有还原性.
(2)b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3 H2O.
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
(4)在用NaOH 溶液吸收SO2 的过程中,往往得到Na2SO3和NaHSO3 的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如表:
①当吸收液中n(SO32-):n(HSO3-)=10:1 时,溶液中离子浓度关系正确的是ac(选填编号).
a.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
c.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2 L.
 在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:(1)a中实验现象是溴水褪色,该现象可证明Na2SO3具有还原性.
(2)b中发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3 H2O.
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去.
(4)在用NaOH 溶液吸收SO2 的过程中,往往得到Na2SO3和NaHSO3 的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如表:
| n(SO3 2-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
a.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
c.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO211.2 L.
17.原子序数依次增大的A、B、C、D、E五种非0族元素组成了某化合物M,其中A是元素周期表中原子半径最小的元素,B元素原子最外层p能级比s能级多一个电子,C、D元素同主族且原子序数D为C的二倍,E元素的原子外围电子排布为(n-1)dn+6ns1.下列关于M的说法不正确的是( )
| A. | 若化合物M其原子个数比为14:4:5:1:1,则其化学式为[Cu(NH3)4]SO4•H2O | |
| B. | 若该化合物为配合物,则E离子给出孤对电子 | |
| C. | C元素与D元素形成的一种具有较强还原性的分子的VSEPR模型为平面三角形 | |
| D. | DC42-空间构型为正四面体 |
4.2014年10月8日,诺贝尔化学奖授予了三位超高分辨率荧光显微镜的贡献者,这是迄今人类玻璃显微镜的最高成就,玻璃属于( )
| A. | 纯净物 | B. | 混合物 | C. | 单质 | D. | 化合物 |
1.设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.1mol铁在氯气中完全反应失去的电子数为0.2NA | |
| B. | 常温常压下,1L 0.1mol•L-1氯化铝溶液中含有0.3 NA个Cl- | |
| C. | 标准状况下,22.4L氨水中含有NA个NH3分子 | |
| D. | 常温常压下,24g镁条投入足量稀硫酸中生成22.4L H2 |
2. 按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )
按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )
 按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )
按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )| A. | 打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处 | |
| B. | 开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应 | |
| C. | 反应一段时间后,左端液面上升,进入长颈漏斗,a处有无色气体产生 | |
| D. | 若用苯或酒精来代替煤油,可观察到相同的实验现象 |