题目内容
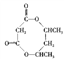
【题目】一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应:A(s)+2B(g) ![]() C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是
C(g)+2D(g) ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是

A.增加A的物质的量,正反应速率加快
B.平衡时,其他条件不变,当温度升高时,θ变大
C.图中曲线的斜率表示反应的化学平衡常数
D.平衡时,其他条件不变,再通人B,则反应混合物的温度升高
【答案】D
【解析】
试题分析:A、由于A是固体,增加A的量不影响化学反应速率,故A错误;B、平衡时,其他条件不变,当温度升高时,平衡向逆反应方向移动,θ变小,故B错误;C、温度一定时,化学平衡常数是定值,结合平衡常数概念可知,K=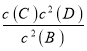 ,图中曲线的斜率是C和B物质的量计算得到,不能表示化学平衡常数,故C错误;D、通入B,平衡正向移动,反应放出更多的热,导致体系温度升高,故D正确;故选D。
,图中曲线的斜率是C和B物质的量计算得到,不能表示化学平衡常数,故C错误;D、通入B,平衡正向移动,反应放出更多的热,导致体系温度升高,故D正确;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】通过对煤的综合利用可得到洁净的燃料和多种化工原料,也可减少环境呢污染。煤的间接液化可得到甲醇。
(1)已知:CH3OH、H2的燃烧热(△H)分别为-726.5kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是____________。
(2)一定条件下,CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
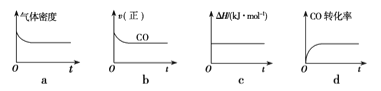
①在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
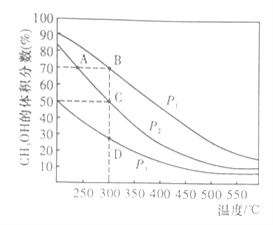
A、B、C三点平衡常数KA、KB、KC的大小关系是___________;压强:P1____P2(填“>”、“<”或“=”)
逆反应速率:v逆(A)______v逆(B)(填“>”、“<”或“=”)
在C点,CO的转化率为__________;
在C点,若再按物质的量之比1:2充入一定量的CO和H2,当其它条件不变,达到新的平衡时,CH3OH的体积分数__________(填“增大”、“减小”或“不变”)。
②若在恒温恒容条件下,能表示该可逆反应达到平衡状态的有__________。
A. 混合气体的密度保持不变
B. 混合气体的平均相对分子质量保持不变
C. 容器内的压强保持不变
D. 单位时间内每消耗1molCO的同时,生成2molH2
E. CO、H2、CH3OH的浓度保持不变
F. CO、H2、CH3OH的浓度之比为1:2:1
(3)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4×10-7 | 1.3×10-7 |
Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为________;常温下,0.1mol·L-1NaHCO3溶液和0.1mol·L-1NaHS溶液的pH相比,pH较小的为______溶液(填化学式)。
【题目】已知反应 Fe(s) + CO2(g) ![]() FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.4 |
(1)若500℃时进行反应①,CO2的起始浓度为2mol﹒L-1,CO的平衡浓度为__________。
(2)该反应为__________(选填“吸热”或“放热”)反应。
(3)700℃时反应达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.CO2 C.升高温度到900℃ D.使用合适的催化剂
E.增加Fe的量
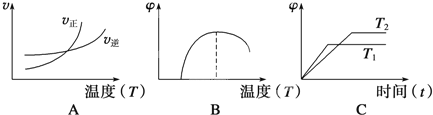
(4)下列图像符合该反应的是__________(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。