题目内容
【题目】已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积关系,合理的是
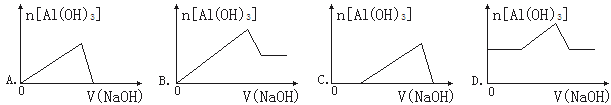
【答案】C
【解析】
试题分析:浓度均为0.1molL-1的Fe(NO3)3和Al(NO3)3混合溶液中,溶液中铁离子、铝离子的浓度相同为0.1mol/L,Al(OH)3的Ksp或溶解度远大于Fe(OH)3,故向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,沉淀的质量减少,由于氢氧化铁不溶于碱,故沉淀减少到一定值不再变化,为氢氧化铁的物质的量。A、向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,故开始加入氢氧化钠溶液不能立即产生氢氧化铝沉淀,图象与实际不相符,故A错误;B、向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,故开始加入氢氧化钠溶液不能立即产生氢氧化铝沉淀,图象与实际不相符,故B错误;C、铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,图象与实际相符合,故C正确;D、加入氢氧化钠一定体积后才会产生氢氧化铝沉淀,故D错误;故选C。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH1=+489.0kJ·mol-1,
C(s) +CO2(g)=2CO(g) ΔH2=+172.5kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为_________ 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
CH3OH(g) +H2O(g)测得CH3OH的物质的量随时间的变化见图1。
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2、3 mol H2 | a mol CO2、b mol H2 |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。

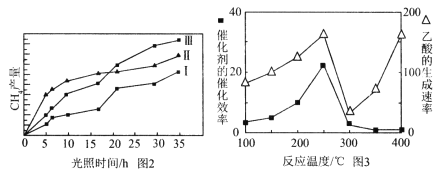
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是__________________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________。
