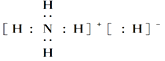题目内容
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
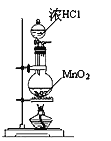
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
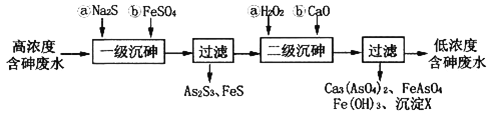
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为________;砷酸的第一步电离方程式为________________________。
(2)“一级沉砷”中FeSO4的作用是___________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为______________________________________________________________。
(3)沉淀X为___________(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
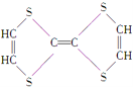
(4)AsH3的电子式为_______________.
(5)步骤2的离子方程式为______________________________________________。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,则该排放的废渣中砷元素的含量_______(填“符合”、“不符合”)排放标准.
【答案】+3 H3AsO4![]() H++H2AsO4- 沉淀过量的S2-,使As2S3(s)+3S2-(aq)
H++H2AsO4- 沉淀过量的S2-,使As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O CaSO4
2AsS33-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O CaSO4 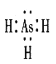 12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+ 不符合
12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+ 不符合
【解析】
本题主要考查金属冶炼过程产生的含砷有毒废弃物的处理与检测。
I.(1)根据化合物中元素化合价代数和为0,由H3AsO3中H为+1和O为-2计算可得亚砷酸中砷元素的化合价为+3;砷酸的第一步电离方程式为H3AsO4![]() H++H2AsO4-。
H++H2AsO4-。
(2)“一级沉砷”中FeSO4的作用是沉淀过量的S2-,Fe2++S2-![]() FeS↓,使As2S3(s)+3S2-(aq)
FeS↓,使As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq)平衡左移,提高沉砷效果;“二级沉砷”中H2O2将亚砷酸氧化为砷酸,最终生成溶解度较小的砷酸盐,H2O2与含砷物质反应的化学方程式为H3AsO3+H2O2=H3AsO4+H2O。
2AsS33-(aq)平衡左移,提高沉砷效果;“二级沉砷”中H2O2将亚砷酸氧化为砷酸,最终生成溶解度较小的砷酸盐,H2O2与含砷物质反应的化学方程式为H3AsO3+H2O2=H3AsO4+H2O。
(3)沉淀X为CaSO4 。
Ⅱ.(4)AsH3的电子式为 。
。
(5)步骤2的离子方程式为12Ag++2AsH3+3H2O=12Ag↓+As2O3+12H+。
(6)1g废渣样品As的质量小于3.0×10-6g即3.0×10-3g·kg-1>4.0×10-5g·kg-1,则该排放的废渣中砷元素的含量不符合排放标准。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572kJ的热量,则表示H2的燃烧热的热化学方程式为________________________________。
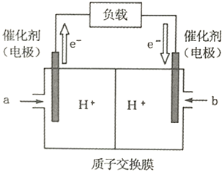
(2)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从_________处通入(填“a”或“b”),电池内部H+向_________(填“左”或“右”)移动。写出电池负极的电极反应式_________________________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H-H | N-H | N≡N |
键能/ kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)=2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值__________。
(4)已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(1) △H3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=_______________。