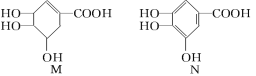题目内容
【题目】两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4B.CH4 C3H6
C.C2H4 C3H4D.C2H4 CH4
【答案】B
【解析】
设混合烃的平均分子式为![]() ,则有CxHy+(x+
,则有CxHy+(x+![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O,
H2O,![]() 时生成的水为气体,有机物燃烧前后体积不变,则
时生成的水为气体,有机物燃烧前后体积不变,则![]() ,解答y=4,即混合烃中平均含有H原子数为4。
,解答y=4,即混合烃中平均含有H原子数为4。
A.![]() 、
、![]() 中H原子数都为4,平均值恒为4,符合题意,故A不选;
中H原子数都为4,平均值恒为4,符合题意,故A不选;
B.![]() 、
、![]() 中H原子数分别为4、6,平均值不可能为4,故B选;
中H原子数分别为4、6,平均值不可能为4,故B选;
C.![]() 、
、![]() 中H原子数都为4,平均值恒为4,符合题意,故C不选;
中H原子数都为4,平均值恒为4,符合题意,故C不选;
D.![]() 、
、![]() 中H原子数都为4,平均值恒为4,符合题意,故D不选;
中H原子数都为4,平均值恒为4,符合题意,故D不选;
故选:B。

【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。