��Ŀ����
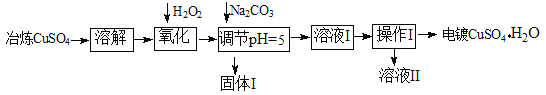
����Ŀ�����������ù�ҵұ������ͭ(����Fe2+��AsO2-��Ca2+������)�ᴿ�Ʊ��������ͭ���������̡�
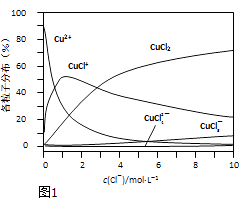
��֪����Fe3+ Cu2+ ��ʼ������pH�ֱ�2��7��5��4����ȫ������pH�ֱ�Ϊ3��7��6��4;
��KSP[(Cu(OH)2]=2��10-20
��1���ܽ��������Ҫ���ƺ�ͭ64g/L������ͭ��Һ100L����Ҫ����ұ��������ͭ����������Ϊ Kg��
��2�����������з��������ӷ�Ӧ����ʽΪ��
��AsO2�� + H2O2+ H+=H3AsO4 �� H3AsO4+ Fe3+=FeAsO4��+ 3H+
��3����Ҫ�������pH����Һ��Fe3+�Ƿ������������ ����������Ҫ����Һ����ϡ�ͣ�ϡ�ͺ����Һ��ͭ����Ũ������ܳ��� mol��L-1��
��4������I����Ҫ�ɷֳ� FeAsO4��� ��������Ϊ
��5���������ϵ�Ƽ�����ͭ��Ϊ�������Һ������ͭ�������������ʣ��Ʊ���ͭ��д�����������ĵ缫��Ӧ����ʽ
���𰸡���16����
��1��16 ��2����
��2��H2O2+2 H+ +2Fe2+ = 2Fe3+ +2H2O ��2����
��3��ȡ������Һ�����Թ�, ���뼸��KSCN��Һ������Һ�����ֺ�ɫ����˵��Fe3+�Ѿ�������2��10-2
����2�֣���4�֣�
��4��Fe(OH)3��CaCO3����1�֣���2�֣�������Ũ������ȴ�ᾧ�����˸��2�֣�������������ɣ�
��5��Fe��2e��= Fe2+ ��Cu ��2e��= Cu2+ ����2������4����
��������
�����������1��m��CuSO4��=64g/L��100L����64/160��=16000g=16Kg��
��2����Һ�к����л�ԭ�Ե�Fe2+��H2O2��Fe2+����������ԭ��Ӧ�����ӷ���ʽΪ��H2O2+2 H+ +2Fe2+ = 2Fe3+ +2H2O��
��3��Fe3+����SCN��Ӧ����Һ��Ϊ��ɫ�������������pH����Һ��Fe3+�Ƿ��������������ȡ������Һ�����Թ�, ���뼸��KSCN��Һ������Һ�����ֺ�ɫ����˵��Fe3+�Ѿ���������Ϊ��Ҫ����Һ��pH������5����c��OH��=10-9molL1������KSP[(Cu(OH)2]�ɵ�Cu2+ǡ�ó���ʱ��Cu2+Ũ��Ϊ��c��Cu2+��=2��10-20����10-9��2=2��10-2��ϡ�ͺ����Һ��ͭ����Ũ������ܳ���2��10-2molL1��
��4������Na2CO3��CO32��Ca2+��Ӧ����CaCO3������Fe3+��ʼ������pH�ֱ�2��7����ȫ������pH�ֱ�Ϊ3��7������pH������5ʱ��Fe3+ת��ΪFe(OH)3��������������I����Ҫ�ɷֳ� FeAsO4���Fe(OH)3��CaCO3����������ͼ��֪�����������õ��������ͭ����ҺII����������Ϊ������Ũ������ȴ�ᾧ�����˸�����
��5������ͭ�������������ʣ��Ʊ���ͭ������Ϊ��ͭ����ͭ��Fe��Cu������ʧȥ���ӣ��������������ĵ缫��Ӧ����ʽΪ��Fe��2e��= Fe2+ ��Cu ��2e��= Cu2+��

����Ŀ����ҵ�����������������Ⱦ���������·�Ӧ��CH4��g��+2NO2��g��N2��g��+CO2��g��+2H2O��g����H=a kJ/mol ���¶�T1��T2ʱ���ֱ�0.50mol CH4��1.2mol NO2�������Ϊ1L���ܱ������У����n��CH4����ʱ��仯�������±�������˵������ȷ���ǣ� ��
�¶� | ʱ��/min | 0 | 10 | 20 | 40 | 50 |
T1 | n��CH4�� | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n��CH4�� | 0.50 | 0.30 | 0.18 | �� | 0.15 |
A.10 min�ڣ�T1ʱCH4�Ļ�ѧ��Ӧ���ʱ�T2ʱС
B.�¶ȣ�T1��T2
C.a��0
D.ƽ�ⳣ����K��T1����K��T2��