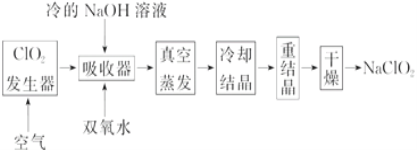
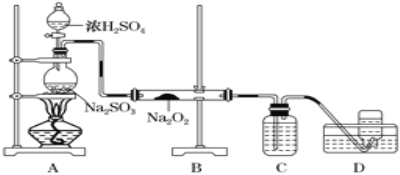
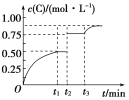
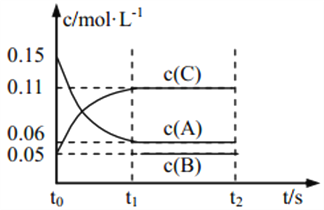
��Ŀ����
����Ŀ��ij��Ӧ�з�Ӧ�����������У�AsH3��H2SO4��![]() ��H3AsO4��H2O��һ��δ֪����X��
��H3AsO4��H2O��һ��δ֪����X��
��1����֪![]() �ڷ�Ӧ�еõ����ӣ���÷�Ӧ�Ļ�ԭ����______________��
�ڷ�Ӧ�еõ����ӣ���÷�Ӧ�Ļ�ԭ����______________��
��2����֪0.2mol![]() �ڷ�Ӧ�еõ�1mol��������X����X�Ļ�ѧʽΪ_____________��
�ڷ�Ӧ�еõ�1mol��������X����X�Ļ�ѧʽΪ_____________��
��3������������Ӧ����֪_________��
a�������ԣ�![]() b�������ԣ�
b�������ԣ�![]()
c����ԭ�ԣ�![]() d����ԭ�ԣ�
d����ԭ�ԣ�![]()
��4�����������ͻ�ԭ���Ļ�ѧʽ������ƽ���ϵ���������з����У����������ת�Ƶķ�
�����Ŀ�� ___________��
___________��
���𰸡�AsH3 Br2 ac ![]()
��������
��������Ϣ��֪��KBrO3�ڷ�Ӧ�еõ����ӣ�����Ϊ��������AsH3�ǻ�ԭ��������������ԭ��Ӧ�Ĺ��ɽ�������жϡ�
��1��KBrO3�ڷ�Ӧ�еõ����ӣ�������һ�ֻ��ϼ۱仯��Ԫ���ڷ�Ӧ��ʧȥ���ӱ�����������������AsԪ�ػ��ϼ۷����˱仯���ͼ�̬��AsH3�ǻ�ԭ����![]() ���������
���������
��2��0.2mol KBrO3�õ�1mol���ӣ�˵��+5�۵�BrԪ���ڷ�Ӧ�н�����5�ۣ�����x�Ļ�ѧʽΪBr2������Ϊ��ԭ���
��3���������������Դ�����������������ԣ���ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԡ�
a�������ԣ�![]() ��a��ȷ��
��a��ȷ��
b�������ԣ�![]() ��b����
��b����
c����ԭ�ԣ�![]() ��c��ȷ��
��c��ȷ��
d����ԭ�ԣ�![]() ��d����
��d����
��ѡac.
��4������������ԭ��Ӧ�е��ӵ�ʧ��ȵĹ��ɿ���ƽ�÷���ʽΪ��8KBrO3��5AsH3��4H2SO4===4K2SO4��4Br2��5H3AsO4��4H2O���ʵ���ת�Ƶķ������Ŀ�ɱ�ʾΪ��![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�