题目内容
【题目】(1)①CaCO3(s)=CaO(s) + CO2(g) ΔH = + 177.7 kJ·mol-1
②C(s) + H2O(g)=CO(g) + H2(g) ΔH = -131.3 kJ·mol-1
③1/2H2SO4(l) + NaOH(l)=1/2Na2SO4(l) + H2O(l) ΔH = -57.3 kJ·mol-1
④C(s) + O2(g)=CO2(g) ΔH = -393.5 kJ·mol-1
⑤CO(g) + 1/2O2(g)=CO2(g) ΔH = -283 kJ·mol-1
(a)上述热化学方程式中表示不正确的有__(填序号)。
(b)根据上述信息,写出C转化为CO的热化学方程式__________。
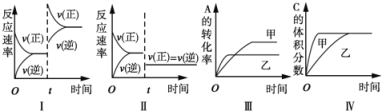
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g)ΔH = -241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为__kJ·mol-1。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) ΔH =﹣574 kJ·mol-1
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) ΔH =﹣1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为__(用阿伏加德罗常数NA表示),放出的热量为__kJ。
(4)下列有关中和热的说法正确的是(________)
A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH= -57.3 kJ·mol-1
B.准确测量中和热的实验过程中,至少需记录温度4次
C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,测量出的中和热数值偏小
D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1,则该反应的中和热为57.3 kJ·mol-1
【答案】②③ C(s) + 1/2O2(g)=CO(g) ΔH = -110.5 kJ·mol-1 409.0 1.6NA 173.4 C D
【解析】
(1)(a)根据热化学方程式的书写方法,②③都是错误的,错误之处分别是:
②该反应为吸热反应,ΔH>0,应为ΔH = +131.3 kJ·mol-1;
③H2SO4、NaOH、Na2SO4均为溶液,不是纯液体,应用aq表示状态;
故答案为:②③;
(b)已知热化学方程式④C(s) + O2(g)=CO2(g) ΔH = -393.5 kJ·mol-1;⑤CO(g) + 1/2O2(g)=CO2(g) ΔH = -283 kJ·mol-1;根据盖斯定律知:C(s) + 1/2O2(g)=CO(g)可由④-⑤得到,ΔH=-393.5 kJ·mol-1-(-283 kJ·mol-1)= -110.5 kJ·mol-1;则C转化为CO的热化学方程式为:C(s) + 1/2O2(g)=CO(g) ΔH = -110.5 kJ·mol-1;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变的绝对值;H2(g)+1/2O2(g)=H2O(g)ΔH = -241.8 kJ·mol-1,该反应的活化能为167.2kJmol1,则其逆反应的活化能=167.2 kJ·mol-1+241.8 kJ·mol-1=409.0 kJ·mol-1;
(3)已知①CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) ΔH = -574 kJ·mol-1;
②CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) ΔH = -1160 kJ·mol-1;
根据盖斯定律(①+②) /2可得:③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= ![]() = -867 kJmol1,标况下,4.48L甲烷的物质的量为:
= -867 kJmol1,标况下,4.48L甲烷的物质的量为:![]() ,甲烷中碳元素的化合价为-4价,反应产物二氧化碳中C元素化合价为+4价,化合价变化为8,即完全反应1mol甲烷转移了8mol(8NA)电子,则反应0.2mol甲烷转移的电子总数为:0.2mol×8NA=1.6NA;根据热化学方程式③可知,完全反应0.2mol甲烷放热的热量为:867kJmol1×0.2mol=173.4kJ;
,甲烷中碳元素的化合价为-4价,反应产物二氧化碳中C元素化合价为+4价,化合价变化为8,即完全反应1mol甲烷转移了8mol(8NA)电子,则反应0.2mol甲烷转移的电子总数为:0.2mol×8NA=1.6NA;根据热化学方程式③可知,完全反应0.2mol甲烷放热的热量为:867kJmol1×0.2mol=173.4kJ;
(4)A. H+、OH-不是纯液体,应用aq表示状态,应为:H+(aq)+OH-(aq)=H2O(l) △H= -57.3 span>kJ/mol,A项错误;
B. 准确测量中和热的实验过程,每一组完整的实验数据需记录三次温度,分别是第一次测盐酸起始温度,第二次测氢氧化钠起始温度,第三次测混合液的最高温度;而且需重复实验2到4次,则至少需记录温度6次,B项错误;
C. 中和热测定实验成败的关键是保温工作,金属铜的导热效果好于环形玻璃搅拌棒,所以测量出的中和热数值偏小,C项正确;
D. 中和热指的是稀溶液中,酸跟碱发生中和反应生成1 mol水时放出的热量,根据已知热化学方程式可知,生成1mol水放出57.3 kJ的热量,则该反应的中和热为57.3 kJ·mol-1,D项正确;
故答案为:C D。

 阅读快车系列答案
阅读快车系列答案