��Ŀ����
����Ŀ��NaClO2��Ư��������Ư�۵�4��5���� NaClO2�㷺������ֽ��ҵ����ˮ�����ȡ���ҵ������NaClO2�Ĺ����������£�
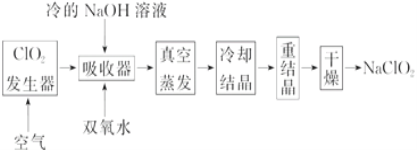
(1)ClO2�������еķ�ӦΪ��2NaClO3��SO2��H2SO4===2ClO2��2NaHSO4��ʵ�ʹ�ҵ�����У�������ơ�Ũ�������ԭ���е�SO2����ԭ��Ϊ_____________(�û�ѧ����ʽ��ʾ)��
(2)��Ӧ��������ClO2��������ͨ��һ����������Ŀ�ģ�________________________��
(3)������������NaClO2�����ӷ�Ӧ����ʽΪ___________________________________��
(4)ij��ѧ��ȤС��������ͼ��ʾװ���Ʊ�SO2��̽��SO2��Na2O2�ķ�Ӧ��
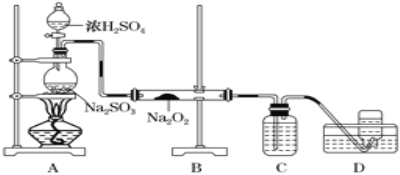
��ʢ��ŨH2SO4��������Ϊ_____��C����Һ��������____________��
��D���ռ����������ʹ�������ľ����ȼ��B�з����ķ�Ӧ����Ϊ__________��Na2O2��SO2=Na2SO4��
���𰸡�S��2H2SO4(Ũ)![]() 3SO2���� 2H2O ���ϳ�ClO2��ȷ���䱻������� 2ClO2��2OH����H2O2=2ClO2����O2��2H2O ��Һ©�� ����δ��Ӧ�Ķ������� 2Na2O2��2SO2=2Na2SO3��O2
3SO2���� 2H2O ���ϳ�ClO2��ȷ���䱻������� 2ClO2��2OH����H2O2=2ClO2����O2��2H2O ��Һ©�� ����δ��Ӧ�Ķ������� 2Na2O2��2SO2=2Na2SO3��O2
��������
�ɷ�Ӧ2NaClO3+SO2+H2SO4�T2ClO2+2NaHSO4�Ʊ�ClO2��ClO2�����NaOH��Һ��Ӧ��NaClO2��Һ�����������������ȴ�ᾧ������õ�NaClO2���ݴ˷������(1)��(3)��
(4)A�Ʊ�����������Na2O2��B�з�Ӧ��C����δ��Ӧ�Ķ�������D���ռ����������ʹ�������ľ����ȼ��˵��������������D�ռ����ɵ��������ݴ˷������
(1)ClO2�������еķ�ӦΪ��������������������������·���������ԭ��Ӧ������ǡ�Ũ����Ҳ�������ɶ�������Ӧ�ķ���ʽΪS+2H2SO4(Ũ) ![]() 3SO2��+2H2O�����Կ�����ǡ�Ũ�������ԭ���е�SO2���ʴ�Ϊ��S+2H2SO4(Ũ)
3SO2��+2H2O�����Կ�����ǡ�Ũ�������ԭ���е�SO2���ʴ�Ϊ��S+2H2SO4(Ũ) ![]() 3SO2��+2H2O��
3SO2��+2H2O��
(2)��Ӧ��������������������ClO2��ͨ��������Խ�����ȫ�ų���ȷ���䱻������գ��ʴ�Ϊ�����ϳ�ClO2��ȷ���䱻������գ�
(3)��������˫��ˮ��ClO2�ڼ��������·���������ԭ��Ӧ����NaClO2����Ӧ�����ӷ���ʽΪ2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O���ʴ�Ϊ��2ClO2+2OH-+H2O2�T2ClO2-++O2+2H2O��
(4)�ٸ���װ��ͼ��ʢ��ŨH2SO4����Ϊ��Һ©����C����Һ������������δ��Ӧ�Ķ������ʴ�Ϊ����Һ©��������δ��Ӧ�Ķ�������
��D���ռ����������ʹ�������ľ����ȼ��˵������������������B�з����ķ�Ӧ����Ϊ����������������Ʒ�Ӧ�����������ƺ���������Ӧ�ķ���ʽΪ2Na2O2+2SO2=2Na2SO3+O2���ʴ�Ϊ��2Na2O2+2SO2�T2Na2SO3+O2��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ijʵ��С��̽�������ڷ�Һ����Ԫ�صļ�̬�����ⶨ�ò����ڷ�Һ����Ԫ�صĺ����Ƿ��ꡣ
![]()
(1)ʵ��һ��̽�������ڷ�Һ����Ԫ�صļ�̬��
��ͬѧ��ȡ1 mL�����ڷ�Һ������K3[Fe(CN)6]�����軯�أ���Һ��������ɫ������֤���ò����ڷ�Һ����Ԫ����Fe2+��ʽ���ڡ�
��ͬѧ��ȡ5 mL�����ڷ�Һ������10��KSCN��Һ�������ٵ���10��˫��ˮ��δ������ɫ����ͬѧΪ����û�г��ֺ�ɫʵ�������ԭ��������Һƽ����Ϊ3�ݽ���̽����
ԭ�� | ʵ����������� | ���� | ||
1 | ����ԭ��Ӱ�� | ��ͬѧ�۲�ò����ڷ�Һ�����ϱ�������������ά����C��ά����C�л�ԭ�ԣ��������Ǣ�______ | ȡ��1����Һ����������������˫��ˮ����δ����ɫ���� | �ų���_________Ӱ�� |
2 | ����ԭ�� | ���Ӣ�________��Һ��д��ѧʽ��̫�٣�����û�дﵽ��ӦŨ�� | ȡ��2����Һ�������μӸ���Һ����������Ȼδ���ֺ�ɫ | ˵�����Ǹ���Һ���ٵ�Ӱ�� |
3 | ������ʽ | ���ļ�̬��+3�ۣ������ܲ�������������Fe3+��ʽ���� | ȡ��3����Һ���μ�1��ϡ���ᣬ��ҺѸ�ٱ�Ϊ��ɫ | ˵��Fe3+�Ԣ�_______��ʽ���ڣ��û�ѧ����ʽ������֣�˵�������Ѹ���Ժ�ɫ��ԭ�� |
(2)��ͬѧע���ͬѧ��ϡ����������Һ������һ��ʱ�����ɫ�ֱ�dz�ˣ���������SCN-�и�Ԫ�صĻ��ϼۣ�Ȼ��dz�����Һ��Ϊ���ȷݣ�һ���е���KSCN��Һ�����ֺ�ɫ�ֱ����һ�ݵ���˫��ˮ�����ֺ�ɫ��ø�dz����������Ҳ�̼�����ζ���������ɡ�����ʵ�����������ӷ���ʽ��ʾ���ú���Һ��ɫ��dz��ԭ��________��
(3)ʵ��������������ڷ�Һ����Ԫ�صĺ����Ƿ��ꡣ
�ò����ڷ�Һ��ǩע������Ʒ����������(FeSO4��7H2O)ӦΪ375��425(mg/100 mL)����ʵ��С���������ʵ�飬�ⶨ������Ԫ�صĺ�������˵������ʵ����ά����C��Ӱ�����ų�������Ҫ����ά����C���ĵ�����KMnO4��Һ��
��ȡ�ò����ڷ�Һ100 mL���ֳ��ĵȷݣ��ֱ������ƿ�У����ֱ��������ϡ������
���� ________ʽ�ζ����м���0.002 mol.L-l����KMnO4��Һ������¼��ʼ�����
�۵ζ���ֱ����Һǡ��_____________��30���ڲ���ɫ����¼ĩ�����
���ظ�ʵ�顣�������ݼ��㣬ƽ����������KMnO4��Һ�����Ϊ35.00 mL������ÿ100 mL�ò����ڷ�Һ�к���Ԫ��__________mg����FeSO4��7H2O���������㣩���жϸò����ڷ�Һ����Ԫ�غ���___________����ϸ��ϸ���